
多重免疫组化使我们能够在一张切片中检测两个或者更多目标,特别是当单独的免疫组化(IHC-P)不能足够准确地显示预期的结果:例如,使用了两种或者多种标记物的免疫表型细胞。多重免疫组化(IHC-P)可以通过荧光团或者显色底物进行。然而,多重法也有很多技术上的挑战,因此一些重要的问题需要被考虑:
一级抗体的宿主种类
当用间接免疫组化(IHC)方法来检测抗体抗原时(见 Secondary-systems),理想的一级抗体应该来自不同的宿主种类来避免二级系统的交叉反应。来自同一宿主种类但是不同亚型的单克隆抗体可以用亚型特定的二级抗体来检测。在显色 IHC-P中,只有当一级抗体来自于同一种类并且亚型可用时,可能高温或者低pH值的缓冲液可用来洗脱第一轮的抗体。当你的实验方案中包含一个高温变性步骤时,可以考虑采用抵御高温的基质,例如DAB。
显色基质颜色的光谱分化与相容性
在免疫荧光法中,使用带有窄发射光谱的荧光团,并且在显微镜中使用窄带通滤波器可避免光谱渗透,同时可以对准具有更亮荧光团的低丰度蛋白。组织的自体荧光可能会妨碍结果的解释,特别是在绿色和红色通道的荧光团。包括不含抗体和荧光团的对照切片,可以用来检查你的组织中的自体荧光(见:IHC-Controls)。
显色基质的光谱分化可能会相当困难,特别对于共定位目标。混合的颜色应该与单一的染色形成良好的对比。注意显色剂的使用要求,对低丰度目标蛋白使用灵敏度较高的底物。
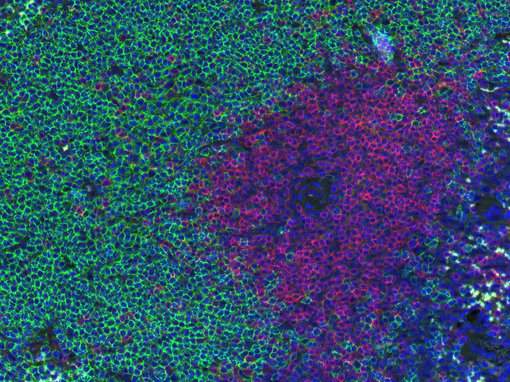
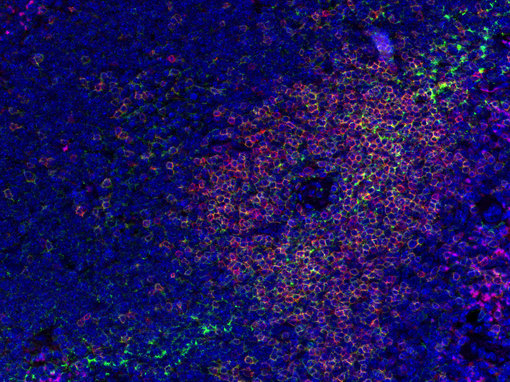
图1:小鼠脾脏中B细胞(CD19,绿色)和T细胞 (CD3e,红色)的双染色。
图2:小鼠脾脏中一般T细胞标记物(CD3e,红色)与 抗CD4 (绿色)的双染色。
二级系统的交叉反应
二级抗体可能会与组织中内源免疫球蛋白发生交叉反应,或者通过二级抗体的非特异性结合产生假阳性染色。在多重免疫组化中,二级抗体还可以相互产生交叉反应。使用二级抗体不仅预先吸附了待染色物种的Igs,而且还吸附了多重实验方案中使用的其它二级抗体宿主物种的IgGs。除了IHC-Controls中描述的对照,多重实验也应包括在染色方案中只省略一个初级抗体的对照切片(见图1)。
图3显示小鼠脾脏移植人体CD34+细胞中抗小鼠和抗人体Ki67多重实验方案的建立(A1)。一级抗体的特异性已用阳性对照(野生型小鼠脾脏)和阴性对照(人体扁桃体)验证。在染色方案中,二级系统的假定交叉反应通过省略抗人体(第2行)或者抗小鼠(第3行)Ki67来验证。
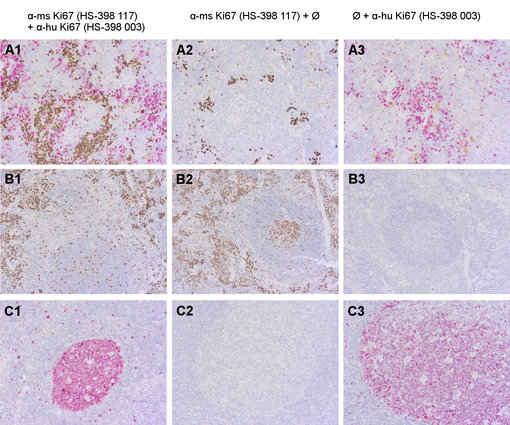
图3:使用兔抗人Ki67(cat. no. HS-398 003; AP-RED, 红色)和大鼠抗小鼠Ki67(cat. no. HS-398 117; DAB, 棕色)抗体,对福尔马林固定石蜡包埋的鼠类进行双染色(A1-3:移植人体CD34+细胞的小鼠脾脏; B1-3:野生型小鼠脾脏)和人体组织 (C1-3:人体扁桃体 )。
图3:使用兔抗人Ki67(cat. no. HS-398 003; AP-RED, 红色)和大鼠抗小鼠Ki67(cat. no. HS-398 117; DAB, 棕色)抗体,对福尔马林固定石蜡包埋的鼠类进行双染色(A1-3:移植人体CD34+细胞的小鼠脾脏; B1-3:野生型小鼠脾脏)和人体组织 (C1-3:人体扁桃体 )。
抗原修复相容性
当一级抗体需要不同的抗原修复条件去生成最优的染色结果时,需要提前进行不同实验方案中小型单染色免疫组化(IHC-P),从而发现对所有一级抗体最相容的抗体修复条件。
多重染色方法筛选
多重IHC-P实验方案可以设计为连续染色或者同时染色。在连续染色实验方案中,一步染色过程关系到另一步染色的成功。当用DAB为显色剂进行第一次染色时,注意DAB‘屏蔽’或者‘掩蔽’的影响-棕色的DAB沉淀物可能会屏蔽第二次IHC-P染色所需的其它靶点。这个实验方案的优点是包括剥离步骤,以避免二级抗体的交叉反应。而在主要用于免疫荧光的同时染色实验方案中,这些一级抗体会同时应用。这个实验方案用时较少,但由于增加的清洗步骤,对显色方案中抗体性能有消极影响。所以当建立多重免疫组化(IHC-P)实验方案时,总是会将单个抗体的结果与其在单个染色中的表现进行比较。