
CD31或者血小板/内皮细胞粘附分子-1(PECAM-1)是一个130KDa的细胞粘附分子,可在内皮细胞的表面高度表达,在较小程度上影响了一系列造血细胞,例如血小板、单核细胞、中性粒细胞和T细胞亚群。在内皮细胞的细胞边界,CD31可形成亲同种抗原的交互作用,可调节血管通透性障碍和白细胞转运功能(如Lertkiatmongkol et al., 2016所述)。成熟的CD31拥有一个574个氨基酸组成的胞外结构域,包含6个免疫球蛋白样的同源结构域。还含有一个复杂的由8个短外显子(外显子9-外显子16)编码的细胞质结构域,易受选择性剪接的影响(Newman et al., 2003)。外显子15的缺失引起CD31 / PECAM-1 mRNA物种编码异构体的c端较短,并具有不同氨基酸序列 (Newman et al., 2003)(图1)。虽然全长PECAM-1是最丰富的种类,选择性剪接外显子15缺失的mRNAs(Δ15 and Δ14,15)经常在小鼠和人类组织中表达(Newman et al., 2003; Sheibani et al., 1999)。重要的是,PECAM-1 Δ15蛋白异构体在蛋白水平上也可在鼠类和人类组织和细胞系中检测到 (Bergom et al., 2008)。HistoSure开发出了新的大鼠单克隆抗小鼠CD31抗体 HS-351 117),可识别包含PECAM-1异构体的外显子15和蛋白异构体Δ15 and Δ14,15。
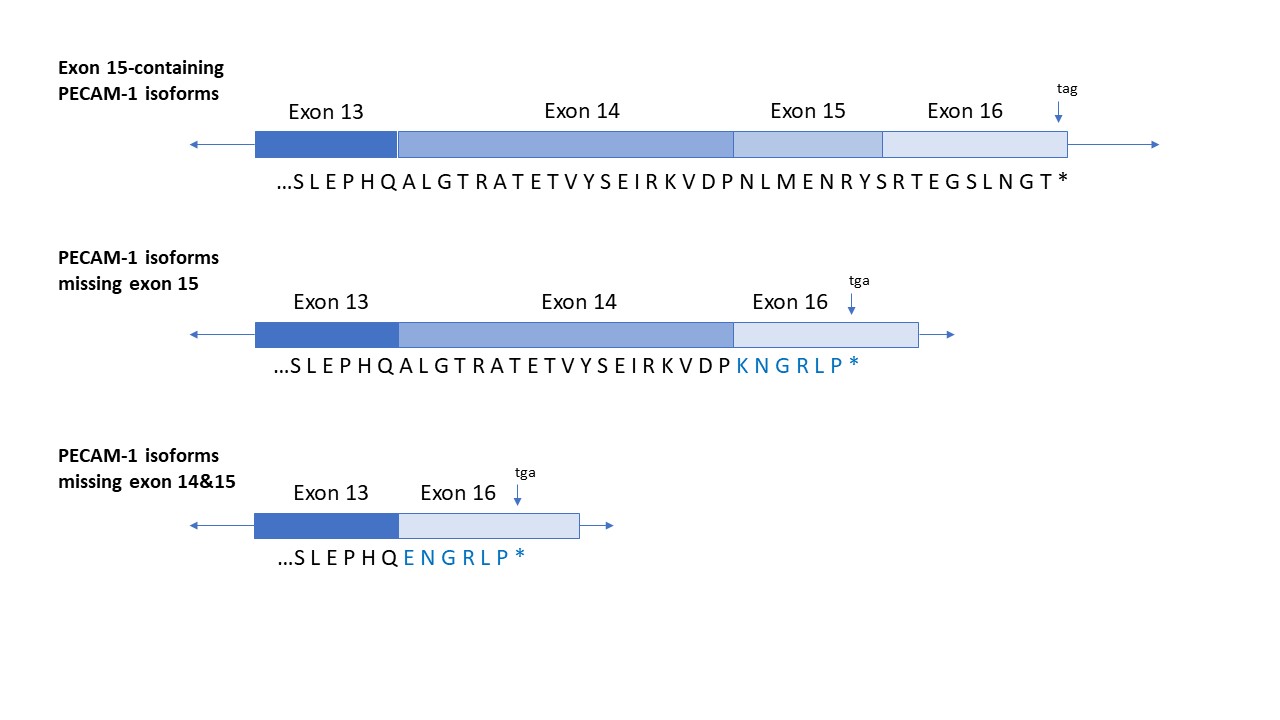
图1:此示意图说明了包含Δ15的小鼠CD31 / PECAM-1异构体的cDNA和由此产生的氨基酸序列。改编自Bergom et al., 2008。
在免疫组织化学(IHC)中,CD31主要用来证明内皮细胞的存在(图2),并可测量血管密度或者新生血管的数量。越来越多的证据表明血管再生和炎症是有关联的,在多种炎症疾病中扮演着合作的角色(如Jeong et al., 2020所述)。一方面,血管再生在中风后促进神经行为恢复中扮演着至关重要的角色,促血管新生基质已在小鼠局部缺血-再灌注损伤模型中被研究过 (Chen et al., 2019)。另一方面,病理性血管再生有助于阿尔兹海默症(如 Jeong et al., 2020所述),对肿瘤生成也极为关键。抗血管生成疗法结合化学疗法或免疫检查点抑制剂对一些晚期癌症是一个很有希望的策略(如reviewed in Majidpoor et al., 2021所述)。当人类抗血管生成策略在临床小鼠模型中被评估时,物种特异性血管标记尤其相关。将人类肿瘤细胞与人类初级内皮细胞(ECs)共移植入免疫缺陷鼠类中,提高了从鼠类血管再生中区分人类内皮细胞的需求(Sanz et al., 2008)。
因此,我们测试了新大鼠单克隆抗小鼠CD31抗体HS-351 117在多种不同保存方法处理过的组织中的免疫组化染色表现 (低温贮藏、甲醛(FA)灌注固定、福尔马林固定石蜡包埋(FFPE)),它可用来在嵌合小鼠-人类模型中检测物种特异性CD31。
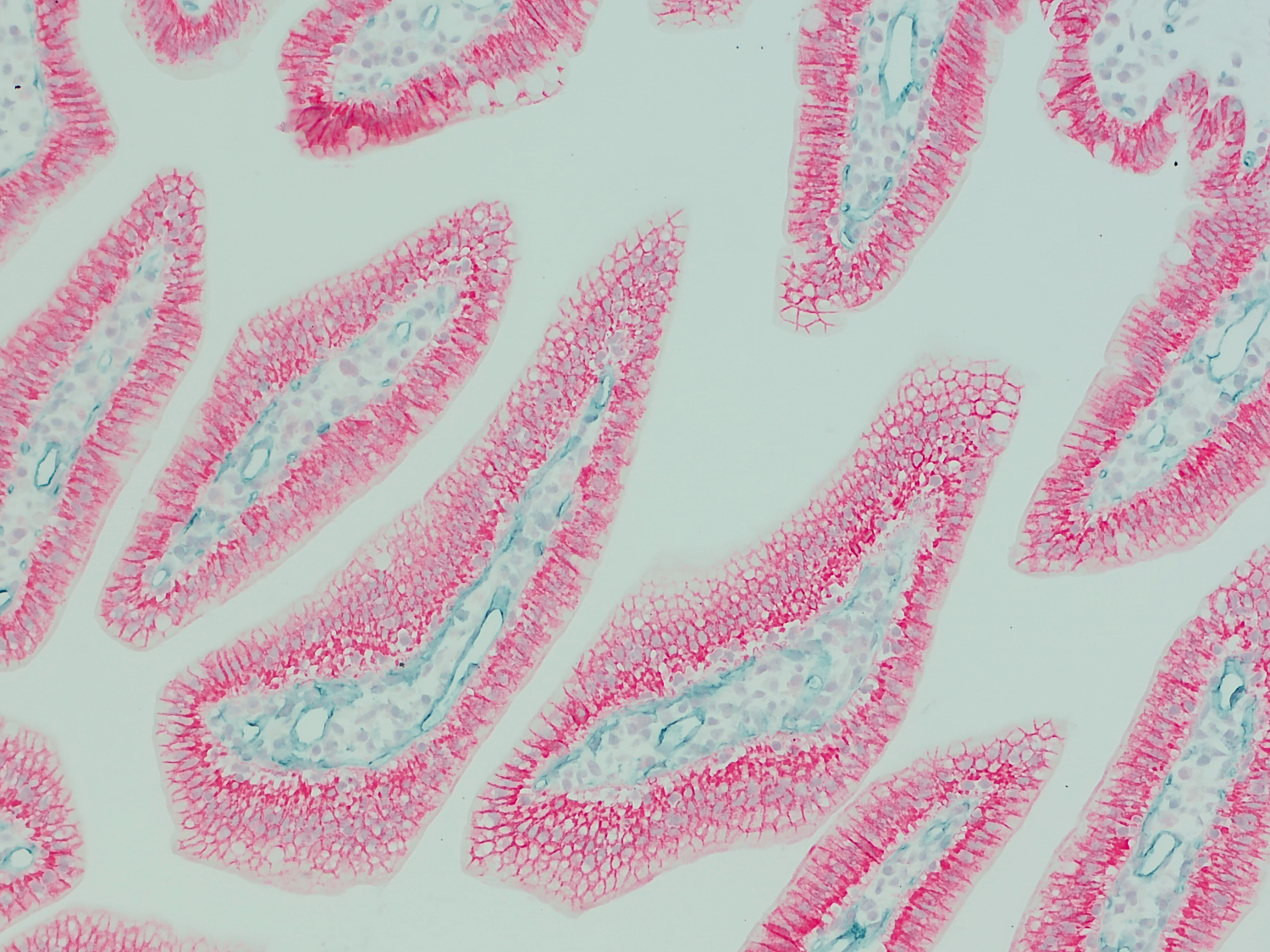
图2:CD31 可视化小鼠小肠中血管(HS-351 117, 1:1000; 蓝绿色)。抗小鼠E-钙粘蛋白抗体被用来检测上皮细胞(HS-467 003, 1:100; pink color)。细胞核被染色为浅蓝色。
我们用自由浮动的经4%甲醛灌注固定的切片或者新鲜冷冻的组织切片,将我们新的大鼠单克隆抗小鼠CD31抗体 (HS-351 117)与引用最多的竞争抗体在小鼠脑切片中的荧光免疫组化进行了比较。
简单来说, 心脏灌注的小鼠脑组织可在4%甲醛中后固定24小时,也可立刻新鲜冷冻在经液氮预冷的异戊烷中。固定好的脑组织用振动切片机切为25 – 50 µm切片。新鲜冷冻的脑组织用低温恒温器切为12 µm切片后安放在载玻片上。新鲜冷冻切片在染色之前,先在室温下在4%甲醛中后固定15分钟。自由浮动和新鲜冷冻组织的染色过程依据SYSY免疫组化标准方案(点击此处可查阅染色方案 )。大鼠单克隆抗小鼠CD31抗体 (HS-351 117)使用的稀释比例为1:500。而对手的抗体稀释由各自供应者决定(SZ31, 1:10; 兔多克隆抗体, 1:50)。
自由浮动的经甲醛固定的小鼠脑切片中的血管(图3,第一行)可用大鼠单克隆抗体(大鼠mAbs)HS-351 117和SZ31进行选择性染色。然而,SZ31显示微弱的细胞核背景染色,而在大鼠mAb HS-351 117染色的脑切片中却不存在。多克隆兔抗体(兔pAb)未能对自由浮动的经甲醛灌注固定的小鼠脑切片中的血管染色。在后固定的新鲜冷冻小鼠脑切片中,所有被检测的抗体显示出了干净的血管染色(图3,第二行),然而用rb pAb的染色却显著微弱。

图3:第一行:抗CD31在4%甲醛灌注固定的小鼠脑切片中的染色。第二行:抗CD31在新鲜冷冻小鼠脑切片中的染色。第一列:抗小鼠CD31大鼠mAb HS-351 117(1:500)。第二列:抗小鼠CD31大鼠mAb SZ31(竞争抗体;1:10)。第三列:抗小鼠CD31 rb pAb(竞争抗体;1:50)。
在FFPE小鼠肝脏、小鼠脑和同源鼠类乳腺癌切片中检测FFPE组织免疫组化染色的抗体性能。一个额外的抗小鼠CD31竞争抗体(兔mAb, 克隆D8V9E)被计入先前抗体小组。在10 mM柠檬酸盐缓冲液中(pH 6.0)使用蔬菜蒸锅进行热诱导抗原修复。 染色依据SYSY IHC-P标准方案进行,用DAB进行显色检测(此处可查阅实验方案)。大鼠单克隆抗小鼠CD31抗体HS-351 117使用比例为1:1000,而竞争抗体稀释度由各自供应者决定(SZ31, 1:10; 兔多克隆抗体, 1:50 稀释; 兔mAb 克隆D8V9E, 1:100)。
只有大鼠mAbs HS-351 117和SZ31和大鼠mAb D8V9E在FFPE小鼠器官切片中显示出中度到重度特异性血管染色(图4)。rb pAb对我们的标准染色方案不够足够敏感,在更大的血管中仅显示非常微弱的染色。由于振动切片的荧光免疫组化染色,大鼠mAb SZ31在小鼠脑中显示出一些细胞核背景染色。
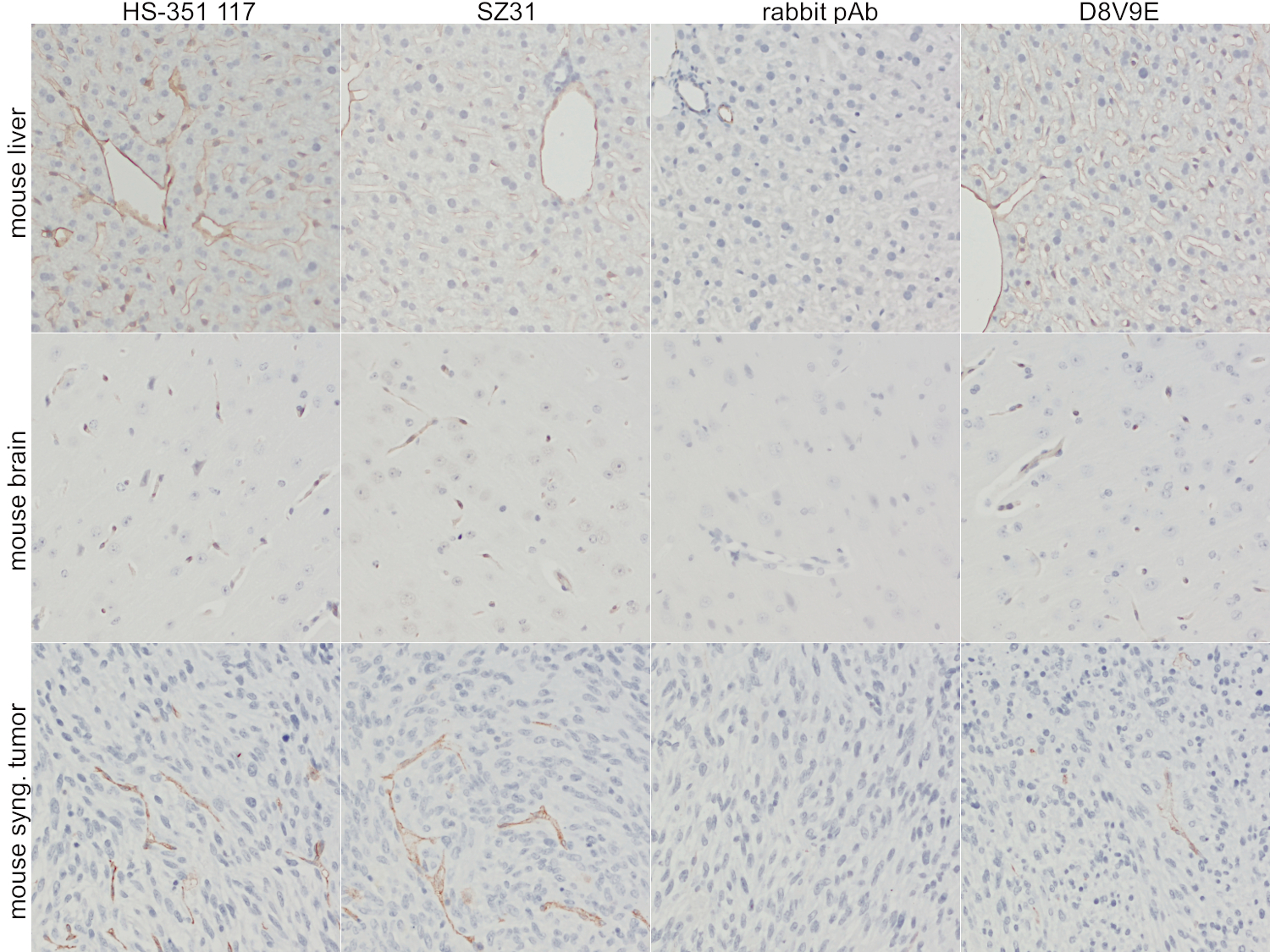
图4:第一行:抗CD31在FFPE小鼠肝脏切片中的染色。第二行:抗CD31在FFPE小鼠脑切片中的染色。第三行:抗CD31在FFPE小鼠乳腺同基因肿瘤切片中的染色。第一列:抗小鼠CD31大鼠mAb HS-351 117 (1:1000)抗体,第二列:抗小鼠CD31大鼠mAb SZ31抗体(竞争对手抗体;1:10)。第三列:抗小鼠CD31 rb pAb抗体(竞争抗体;1:50)。第四列:抗小鼠CD31兔mAb D8V9E抗体(竞争抗体;1:100)。
随后,在大鼠肝脏(图5,第一行)和人类胎盘(图5,第二行)中分别检测了抗CD31抗体与大鼠和人类CD31的交叉反应。只有大鼠mAbs HS-351 117和SZ31与大鼠CD31发生交叉反应。兔mAb克隆D8V9E在大鼠肝脏和人类胎盘中都不显示染色。只有兔多克隆抗体与人类CD31发生了交叉反应,而不是大鼠CD31。
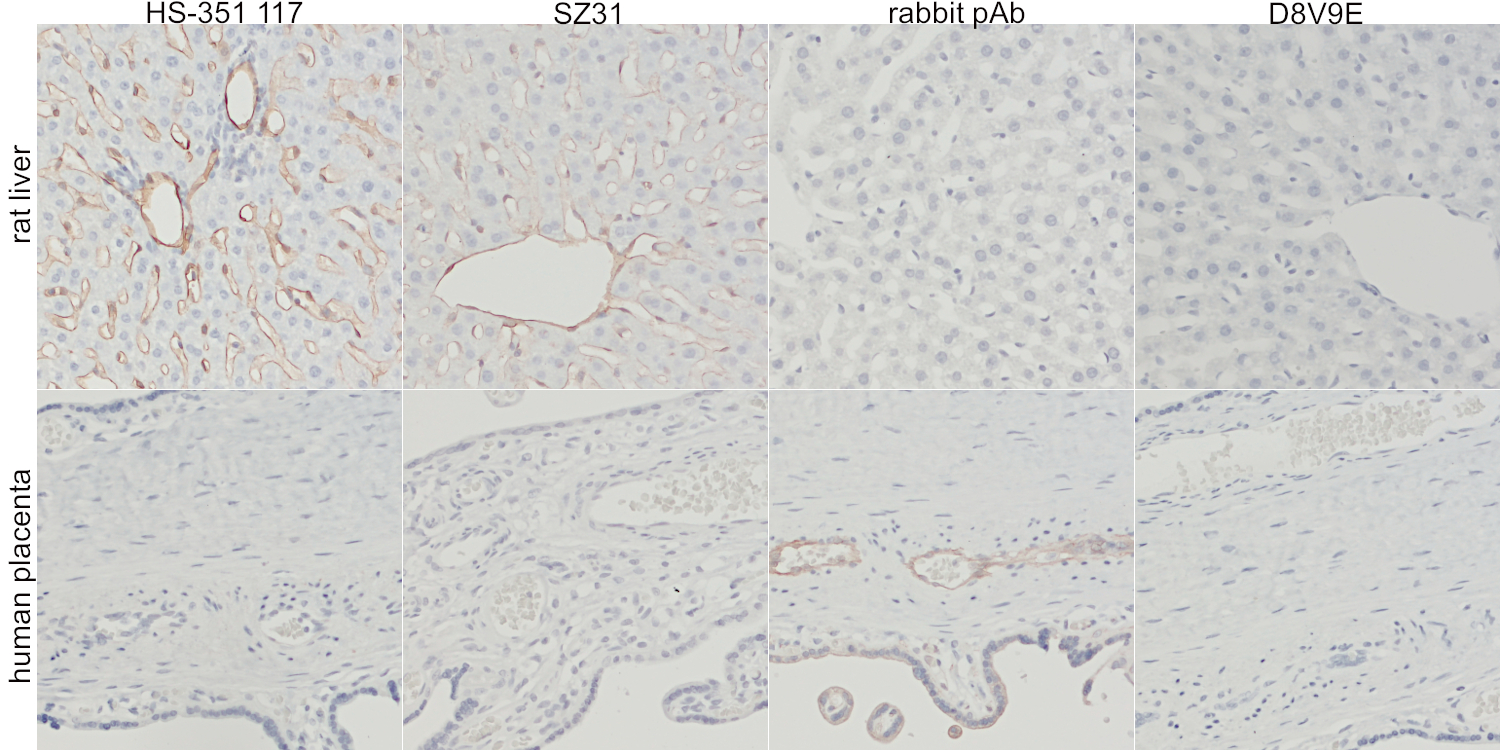
图5:第一行:抗CD31在FFPE大鼠肝脏切片中的染色。第二行:抗CD31在FFPE人类胎盘切片中的染色。第一列:抗小鼠CD31大鼠mAb HS-351 117 (1:1000)。第二列:抗小鼠CD31大鼠mAb SZ31 (竞争抗体;1:10)。第三列:抗小鼠CD31 rb pAb(竞争抗体;1:50)。第四列:抗小鼠CD31兔mAb D8V9E(竞争抗体;1:100)。
最终,应用蛋白免疫印迹在小鼠肺裂解物中检测抗CD31抗体。显色碱性磷酸酶(AP)染色被用于检测(此处可查阅实验方案)。兔mAb克隆D8V9E显示最高敏感度,随后是HS-351 117和SZ31(图6)。兔多克隆抗体显示无染色。
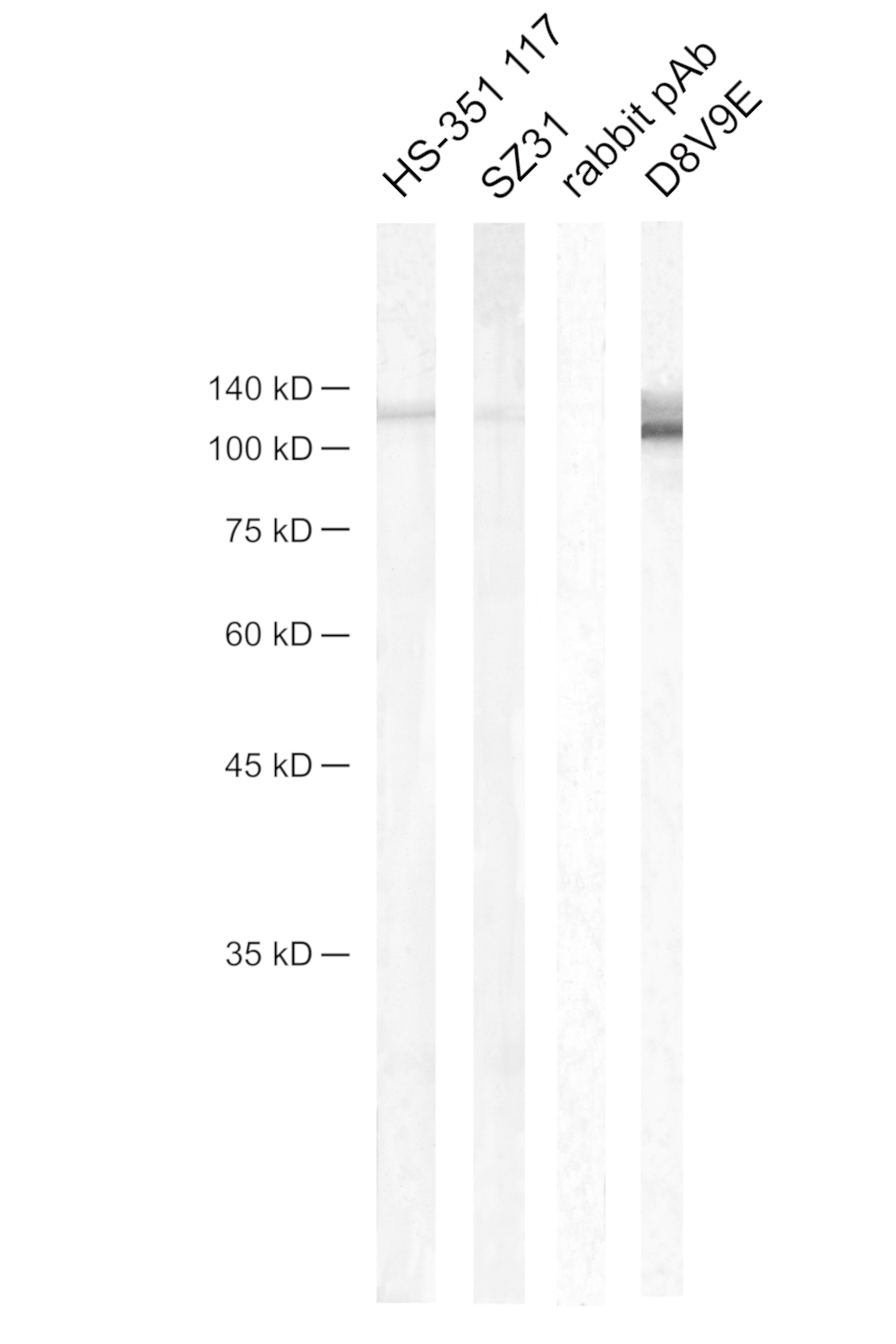
图6:通过蛋白免疫印迹检测小鼠CD31/PECAM 1。蛋白免疫印迹显示小鼠肺裂解物。膜与不同抗体分别进行孵育。泳道1:抗小鼠CD31大鼠mAb HS-351 117 (1:1000);泳道2:抗小鼠CD31大鼠mAb SZ31(竞争抗体;1:10);泳道3:抗小鼠CD31 rb pAb(竞争抗体;1:50);泳道4:抗小鼠CD31兔mAb D8V9E(竞争抗体;1:500)。大约在130 kDa处检测到一个 CD31/PECAM-1特异性条带。
来自HistoSure的新大鼠单克隆抗小鼠CD31抗体(HS-351 117)极佳地适用于探索内皮细胞的存在,并在小鼠和大鼠组织以及人源化小鼠模型的免疫组化应用中量化(新)血管生成:
• HS-351 117 与全长PECAM-1和PECAM-1 Δ15 蛋白异构体(Δ15 and Δ14,15)结合
• HS-351 117 在新鲜冷冻组织、PFA固定的振动切片及FFPE组织切片的免疫组织化学中显示出优越结果
• HS-351 117 适用于检测小鼠和大鼠CD31
• HS-351 117 不与人类CD31结合,因此适用于在人源化小鼠模型中从人类CD31中区分鼠类CD31
• HS-351 117 显示出比对手产品更优越的敏感性和成本效益
| Cat. No. | Product Description | Application | Quantity | Price | Cart |
|---|
HS-351 117 | CD31, rat, monoclonal, purified IgG IgG mouse specific | WB IHC IHC-P IHC-Fr | 100 µg | US$420.00 |
Lertkiatmongkol et al., 2016. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31). PMID: 27055047
Newman et al., 2003. Signal transduction pathways mediated by PECAM-1: new roles for an old molecule in platelet and vascular cell biology. PMID: 12689916
Sheibani et al., 1999. Tissue Specific Expression of Alternatively Spliced MurinePECAM-1 Isoforms. PMID: 9915575
Bergom et al., 2008. An alternatively spliced isoform of PECAM-1 is expressed at high levels in human and murine tissues, and suggests a novel role for the C-terminus of PECAM-1 in cytoprotective signaling. PMID: 18388311
Jeong et al., 2020. Pathological angiogenesis and inflammation in tissues. PMID: 33230600
Chen et al., 2019. Ginsenoside Rg1 promotes cerebral angiogenesis via the PI3K/Akt/mTOR signaling pathway in ischemic mice. PMID: 31132356
Majidpoor et al., 2021. Angiogenesis as a hallmark of solid tumors – clinical perspectives. PMID: 33835425
Sanz et al., 2008. Differential transplantability of human endothelial cells in colorectal cancer and renal cell carcinoma primary xenografts. PMID: 19002108