
• 简介
• SARS-CoV-2的检测
• COVID-19感染在神经功能缺损中的作用
• 产品
• 参考文献
2019年底,当冠状病毒家族的一个新成员在中国湖北省出现时,由于其第一批病例主要表现为严重肺损伤,并伴随着多器官衰竭甚至死亡(Synowiec et al., 2021),因此它被命名为严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)。不出意外,人们发现肺部是感染的主要来源,并且人体肺部尸检样本的免疫组织化学染色发现了高负荷的病原体特异性核衣壳蛋白(图1A和1B)。
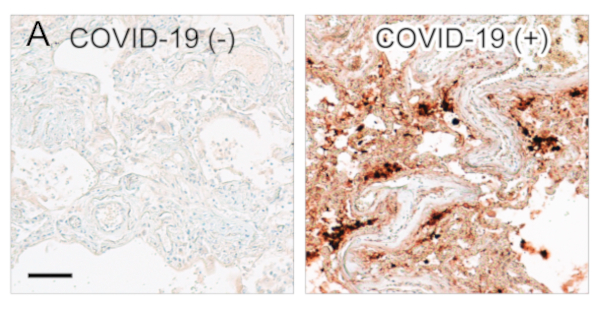
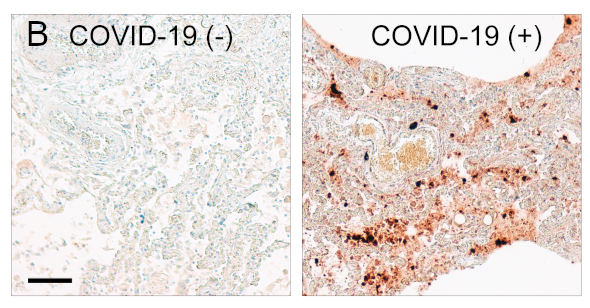
图1:使用抗-SARS-CoV-2 (COVID-19) 核衣壳抗体 (A: cat. no. HS-452 011, 1:1000; B: cat. no. HS-452 111, 1:500),对经福尔马林固定、石蜡包埋的COVID-19患者的肺组织和未被感染的对照肺组织分别进行免疫组化染色。热介导抗原提取和染色通过Ventana Benchmark XT自动染色仪进行。比例尺: 100μm。
肺组织免疫组化染色切片由Dres. Krasemann/Heinrich/Pfefferle(UKE-汉堡/德国)检测和提供。
SARS-CoV-2是一种包膜正义单链RNA病毒。冠状病毒颗粒包括四种主要结构蛋白:刺突、包膜、膜和核衣壳(Synowiec et al., 2021)(图2)。
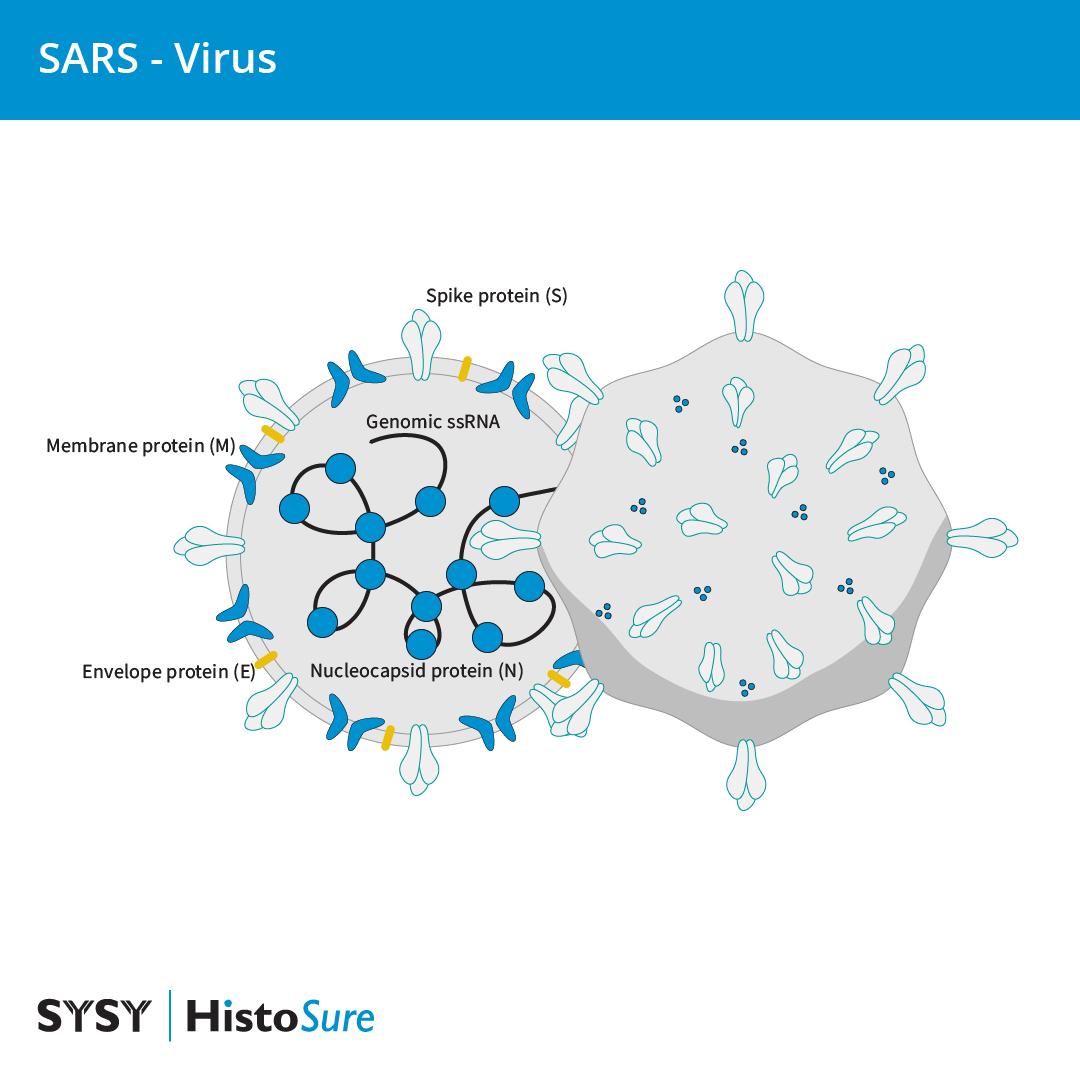
图2:SARS-CoV-2病毒颗粒的示意表示图 (改编自 Pizzato et al., 2022)。病毒粒子含有正义单链RNA,被含有刺突、包膜和膜蛋白的脂质包膜围绕。
刺突蛋白负责判定寄主区域并穿透细胞。刺突蛋白突变可增加感染性和/或导致免疫逃逸(Magazine et al., 2022)。已证实传播性增加或临床情况的变化使得世界卫生组织(WHO)将Sars-CoV-2变体被分类为令人担心的变异株(VOCs),如α、β、γ、δ和omicron变异株。所有的变异株都携带了刺突蛋白的几个突变(Magazine et al., 2022)。核衣壳蛋白定位于病毒粒子内,在进入细胞后调节RNA解绕。在α和omicron变异株中发现的核衣壳突变R203K+G204R可改善SARS-CoV-2的复制、适应度和发病机制(Johnson et al., 2022)。
在COVID-19患者肺部的免疫组织化学研究中发现,刺突蛋白丰度与核衣壳蛋白相比较低,而使用抗核衣壳抗体提高了检测的敏感性(Krasemann et al., 2022)。HistoSure抗SARS-CoV-2核衣壳抗体在多中心试验中被证明具有高度特异性和敏感性,为患者样本中冠状病毒的免疫组织化学检测建立了必要的标准。此外,与直接针对刺突蛋白、非结构蛋白3 (Nsp3)或双链RNA的抗体相比,HistoSure抗SARS-CoV-2核衣壳抗体不仅能够可靠地检测SARS-CoV-2野生型,显示更好的结果,而且能够识别广泛存在的令人担心的变异株,omicron (Krasemann et al., 2022)。
在Sars-CoV-2的重症病例中,有观察到血栓并发症和对多种器官系统如心脏、肝脏、胃肠系统、肾脏和大脑等的不良影响。SARS-CoV-2病毒利用ACE2 (血管紧张素转换酶2)和细胞蛋白酶TMPRSS2(一种刺突启动蛋白酶)进入人体细胞(Gupta et al., 2020)。ACE2是一种主要存在于各种人体器官上皮中的酶,如肺、肝、肾、胃、肠、动脉和静脉、心脏、口腔黏膜、鼻咽、结肠、胸腺、膀胱和中枢神经系统(Ambrocio-Ortiz et al., 2021)。虽然ACE2蛋白在正常肺实质中的表达可以忽略不计,但在感染了致命性COVID-19疾病的患者肺实质中,它的表达却明显升高(Gheware et al., 2022)。
表达ACE2的人类K18-hACE2转基因小鼠可被SARS-CoV病毒感染(McCray Jr. et al., 2006),并可在多种器官例如肺(图3)中检测到SARS-CoV-2 RNA的存在。因此,转基因小鼠是测试针对SARS-CoV-2治疗方法的宝贵工具,例如使用中和抗体(Abassi et al., 2023)。
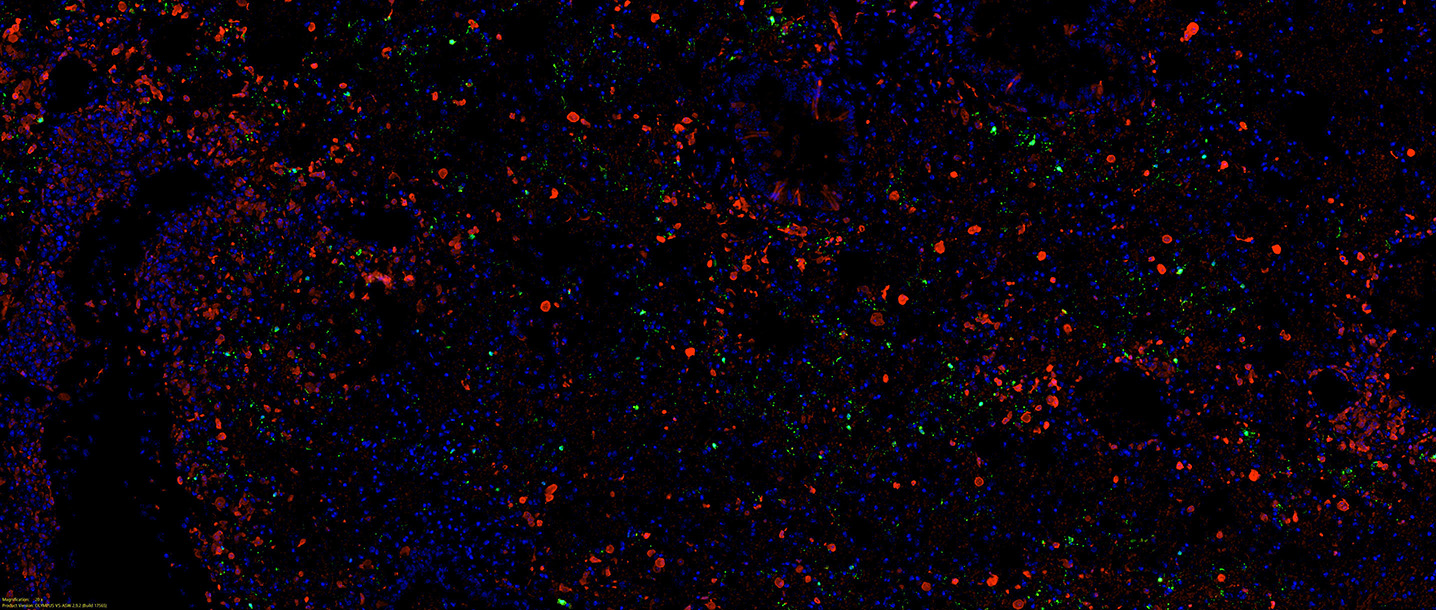
图3:核衣壳CoV-1/2(HS-452 111,绿色)、巨噬细胞标志物MAC2(红色)和细胞核(DAPI,蓝色)在经福尔马林固定、石蜡包埋且感染SARS-CoV-2 (δ变体)的小鼠肺组织中的免疫组化染色的代表性图像。此致:Leila Abassi, Marina Greweling-Pils & Luka Čičin-Šain,亥姆霍兹感染研究中心,布伦瑞克 。
虽然COVID-19被认为主要是一种呼吸道疾病,但COVID-19急性感染也与多种神经损伤有关,如头痛、偶尔出现的幻觉、妄想和行为改变,而脑膜炎、脑炎或脑血管疾病等更严重的并发症则很少见(Vanderheiden and Klein, 2022)。此外,在恢复后,疲劳样症状、神经认知问题、抑郁和其他长期症状可能持续存在。这种“长期新冠肺炎综合征”不依赖于疾病的初始严重程度,但在急性感染后可持续数月(Theoharides and Kempuraj, 2023)。
在大脑中,ACE2可在内皮细胞、脉络膜丛和丘脑腹侧后核中表达(Vanderheiden and Klein, 2022)。相反,蛋白酶TMPRSS2在中枢神经系统中不表达。最近的研究结果支持跨膜受体neuropilin-1 (NRP1)作为SARS-CoV-2在大脑中感染的额外介质而可能发挥的作用(Davies et al., 2020)。
在被Sars-CoV病毒感染的K18-hACE2转基因小鼠的大脑中,抗核衣壳抗体可用来检测神经元细胞中的病毒颗粒(图4和图5)。
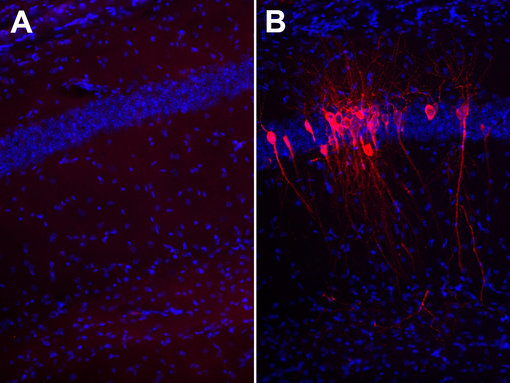
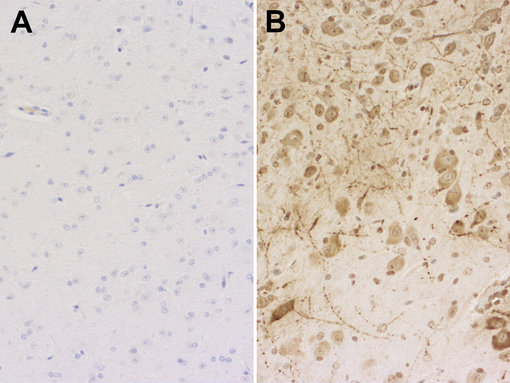
图4:使用单克隆抗-SARS-Cov-2核衣壳抗体克隆#4A8 (cat. no. HS-452 011, 稀释比例 1:1000; 红色),对经PFA 固定的B:感染SARS-CoV-2的K18-hACE2转基因小鼠和A:未感染对照组的大脑切片进行间接免疫染色。细胞核由DAPI染色可见为蓝色。
小鼠由Čičin-Šain教授团队在亥姆霍兹感染研究中心安置和感染。
图5:使用抗-Sars-Cov-2 核衣壳抗体克隆#53E2 (cat. no. HS-452 111, 稀释比例 1:1000; DAB),对经福尔马林固定、石蜡包埋的来自B:感染SARS-CoV-2;A:未感染对照组的K18-hACE2转基因小鼠大脑切片进行免疫组化染色。细胞核由苏木精染色可见为蓝色。
小鼠在亥姆霍兹感染研究中心由Čičin-Šain教授团队安置和感染。
SARS-CoV-2感染在这些转基因小鼠中引起了强烈的神经炎症反应,其特征是小胶质细胞激活(图6)和中性粒细胞浸润(图7)。
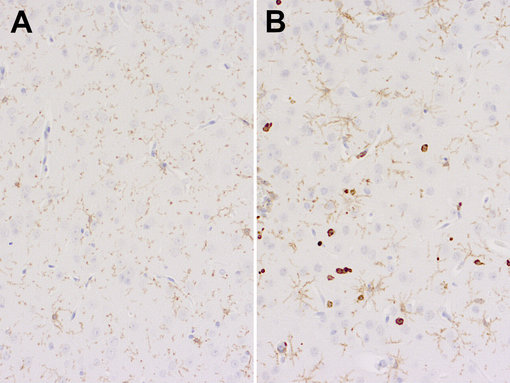
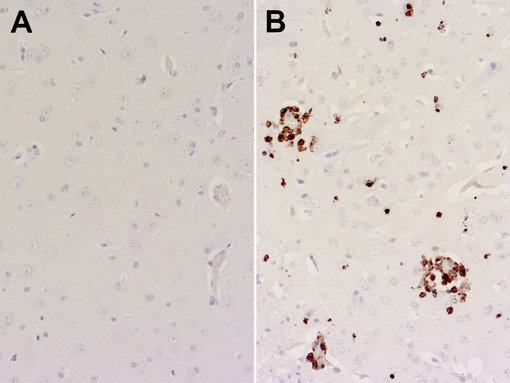
图 6:使用大鼠抗- CD11b (cat. no. HS-384 117, 稀释比例 1:200, DAB)抗体,对经福尔马林固定、石蜡包埋,来自A:未被感染的PBS对照小鼠和B:K18-hACE2转基因小鼠的大脑切片进行免疫组化染色。细胞核由苏木精复染为蓝色。
小鼠在亥姆霍兹感染研究中心由Čičin-Šain教授和Kröger教授合作安置和感染。
图 7:使用大鼠抗-Chil3 (cat. no. HS-442 017, 稀释比例 1:200, DAB)抗体,对经福尔马林固定、石蜡包埋,来自A:未被感染的PBS对照小鼠和B:K18-hACE2转基因小鼠的大脑切片进行免疫组化染色。细胞核由苏木精复染为蓝色。
小鼠在亥姆霍兹感染研究中心由Čičin-Šain教授和Kröger教授合作安置和感染。
尽管大脑感染在人类患者中不太明显,而且在大脑中只发现了几个感染细胞,但在COVID-19患者中也观察到了激活的小胶质细胞,这是神经炎症反应的一个迹象(Matschke et al., 2022)。而即使没有严重形态学改变,并且无明确证据表明病毒可在神经元、胶质细胞或其他中枢神经系统细胞中复制的情况下,也可以在患者中发现神经认知和神经损伤,这表明所观察到的临床症状至少部分可能由中枢神经系统对全身炎症的反应引起(Theoharides and Kempuraj, 2023; Radke et al., 2024)。
这种所谓的“神经-新冠肺炎”是长期新冠肺炎患者的常见现象,到目前为止,还没有批准的药物来治疗这种情况(综述自 Theoharides and Kempuraj, 2023)。
| Cat. No. | Product Description | Application | Quantity | Price | Cart |
|---|
HS-452 111 | Nucleocapsid CoV-1/2, mouse, monoclonal, purified IgG IgG | WB ICC IHC IHC-P | 200 µl | US$420.00 | |
HS-452 111BT | Nucleocapsid CoV-1/2, mouse, monoclonal, purified IgG IgG, biotin | IHC-P ELISA | 100 µg | US$470.00 | |
HS-452 011 | Nucleocapsid CoV-2, mouse, monoclonal, purified IgG IgG | WB ICC IHC IHC-P ELISA | 200 µl | US$420.00 | |
HS-452 011BT | Nucleocapsid CoV-2, mouse, monoclonal, purified IgG IgG, biotin | IHC-P | 100 µg | US$470.00 |
Abassi et al., 2023. Evaluation of the Neutralizing Antibody STE90-C11 against SARS-CoV-2 Delta Infection and Its Recognition of Other Variants of Concerns. PMID: 38005829
Ambrocio-Ortiz et al., 2021. Angiotensin-Converting Enzyme 2 (ACE2) in the Context of Respiratory Diseases and Its Importance in Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Infection. PMID: 34451902
Davies et al., 2020. Neuropilin 1 as a new potential SARS CoV 2 infection mediator implicated in the neurologic features and central nervous system involvement of COVID 19. PMID: 33000221
Gheware et al., 2022. ACE2 protein expression in lung tissues of severe COVID-19 infection. PMID: 35260724
Gupta et al. 2020. Extrapulmonary manifestations of COVID-19. PMID: 32651579
Johnson et al., 2022. Nucleocapsid mutations in SARS-CoV-2 augment replication and pathogenesis. PMID: 34671771
Krasemann et al., 2022. Assessing and improving the validity of COVID-19 autopsy studies - a multicenter approach to establish essential standards for immunohistochemical and ultrastructural analyses. PMID: 35930888
Magazine et al., 2022. Mutations and Evolution of the SARS-CoV-2 Spike Protein. PMID: 35337047
Matschke et al., 2022. Young COVID-19 Patients Show a Higher Degree of Microglial Activation When Compared to Controls. PMID: 35785352
McCray PB Jr. et al., 2006. Lethal infection in K18-hACE2 mice infected with SARS-CoV. PMID: 17079315
Pizzato et al., 2022. SARS-CoV-2 and the Host Cell: A Tale of Interactions. https://doi.org/10.3389/fviro.2021.815388
Synowiec et al., 2021. Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2): a Systemic Infection. PMID: 33441314
Theoharides and Kempuraj, 2023. Role of SARS-CoV-2 Spike-Protein-Induced Activation of Microglia and Mast Cells in the Pathogenesis of Neuro-COVID. PMID: 36899824
Radke et al., 2024. Proteomic and transcriptomic profiling of brainstem, cerebellum and olfactory tissues in early- and late-phase COVID-19. PMID: 38366144
Vanderheiden and Klein 2022. Neuroinflammation and COVID-19. PMID: 35863101