
免疫突触(immune synapse, IS)可被定义为免疫细胞内分子在与另一个细胞界面处的有序重排(Orange, 2008)。免疫突触(Iss)存在于抗原呈递细胞(APCs)或靶细胞和淋巴细胞例如T细胞、B细胞或自然杀伤细胞之间。这种相互作用对于防御广泛的病原体和错乱的宿主细胞是必不可少的。而这种相互作用的失调会使宿主在一个极端情况下或另一个极端是自身免疫中易受病原体或肿瘤逃逸的影响(Dustin, 2014)。免疫突触和神经突触具有共同的特性,如突触间隙、粘附分子、稳定性和极性(图1),但免疫细胞之间的相互作用非常短暂,只持续几分钟到几小时(Friedl et al., 2004)。
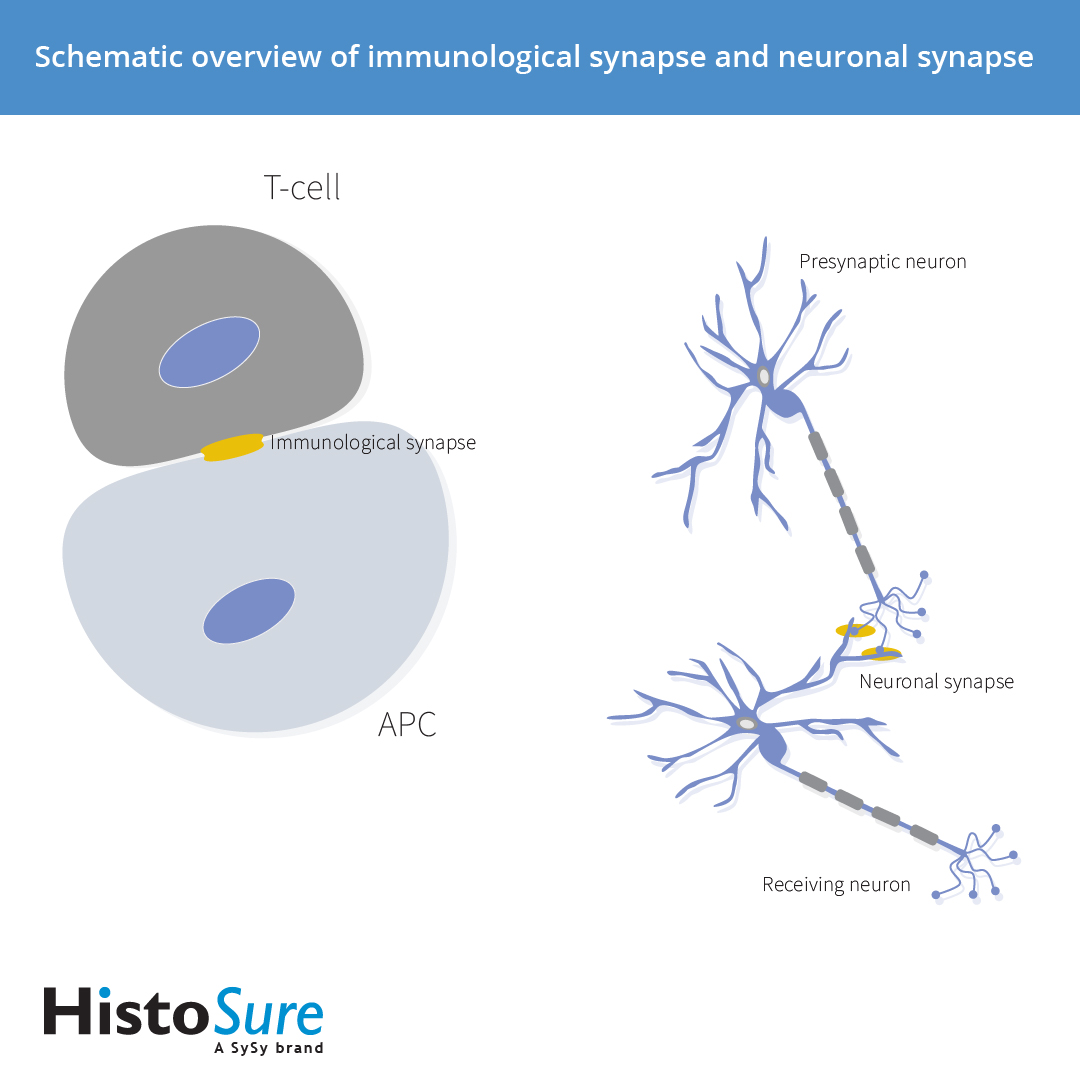
图 1: 免疫突触和神经突触概述示意图
免疫突触根据涉及的细胞类型可分为三种功能亚型 (Mastio et al., 2020): 溶菌性免疫突触(介于细胞毒性免疫细胞和恶性肿瘤细胞之间),抑制性突触 (介于细胞毒性淋巴细胞和健康细胞之间) 和调控性突触(介于细胞毒性细胞和抗原呈递细胞如树突状细胞之间)。因此,免疫突触的形成具有多种不同的功能,例如配体识别、信号的放大和整合、共刺激、细胞毒性、蛋白分泌和转移、决定细胞命运、抑制激活和信号终止(Orange, 2008),而这将取决于参与免疫突触形成的细胞类型和受体(图 2)。
B 细胞可在抗原遇到抗原呈递细胞之后形成免疫突触,通常存在于二级淋巴器官,例如淋巴结和脾脏。抗原识别可由高度特异性B细胞受体(BCRs)诱导。B细胞免疫突触也是抗原内部化的位点,即先在细胞间加工成多肽,随后这些多肽被装载到主要组织相容性复合体(MHC) II分子上,并呈递给CD4+ T辅助细胞,它可为B细胞成熟为产生抗体的浆细胞提供关键的二级信号。B细胞受体(BCR)信号传递是由阴性共受体如CD22 和FcγRII以及阳性共受体如CD19平衡形成的 (Kuokkannen et al, 2015)。
T细胞的激活首先需要T细胞受体(TCR) 与肽结合-主要组织相容性复合体(MHC) II在抗原呈递细胞表面相结合。配体识别会引起T细胞迁移停止,并与相应的抗原呈递细胞(APC)形成免疫突触。而完全激活需要第二种共刺激信号,这种信号是抗原非特异性的,并由在抗原呈递细胞(APCs)和T细胞膜上表达的共刺激分子相互作用提供。经过初次激活后,T细胞可再循环至其它组织区域和器官,在辅助T细胞的情况下可以激活B细胞,或者在细胞溶解T淋巴细胞的情况下,可以杀死细菌或病毒感染的细胞 (Friedl et al., 2004)。
NK 细胞具有依赖于主要组织相容性复合体I类的识别模式,并且可被缺乏MHC I 表达的细胞选择性激活。MHC I 分子可在所有健康的有核细胞中表达。但在被病毒感染或者恶性转化的细胞中的表达会减少或者缺失。免疫突触的效用是由激活和抑制信号之间微妙的平衡来调节的。在溶菌性免疫突触形成时,NK细胞胞外分泌的细胞毒性颗粒中包含穿孔素和各种颗粒酶,它们可以被释放到突触间隙,从而导致靶细胞穿孔和凋亡。此外,NK 细胞可分泌多种细胞因子和趋化因子,如γ干扰素(IFN-γ),α肿瘤坏死因子(TNF-α)或顆粒球-巨噬細胞集落刺激因子(GM-CSF),从而引发辅助性1-biased T 细胞响应 (Waldhauer et al., 2008)。
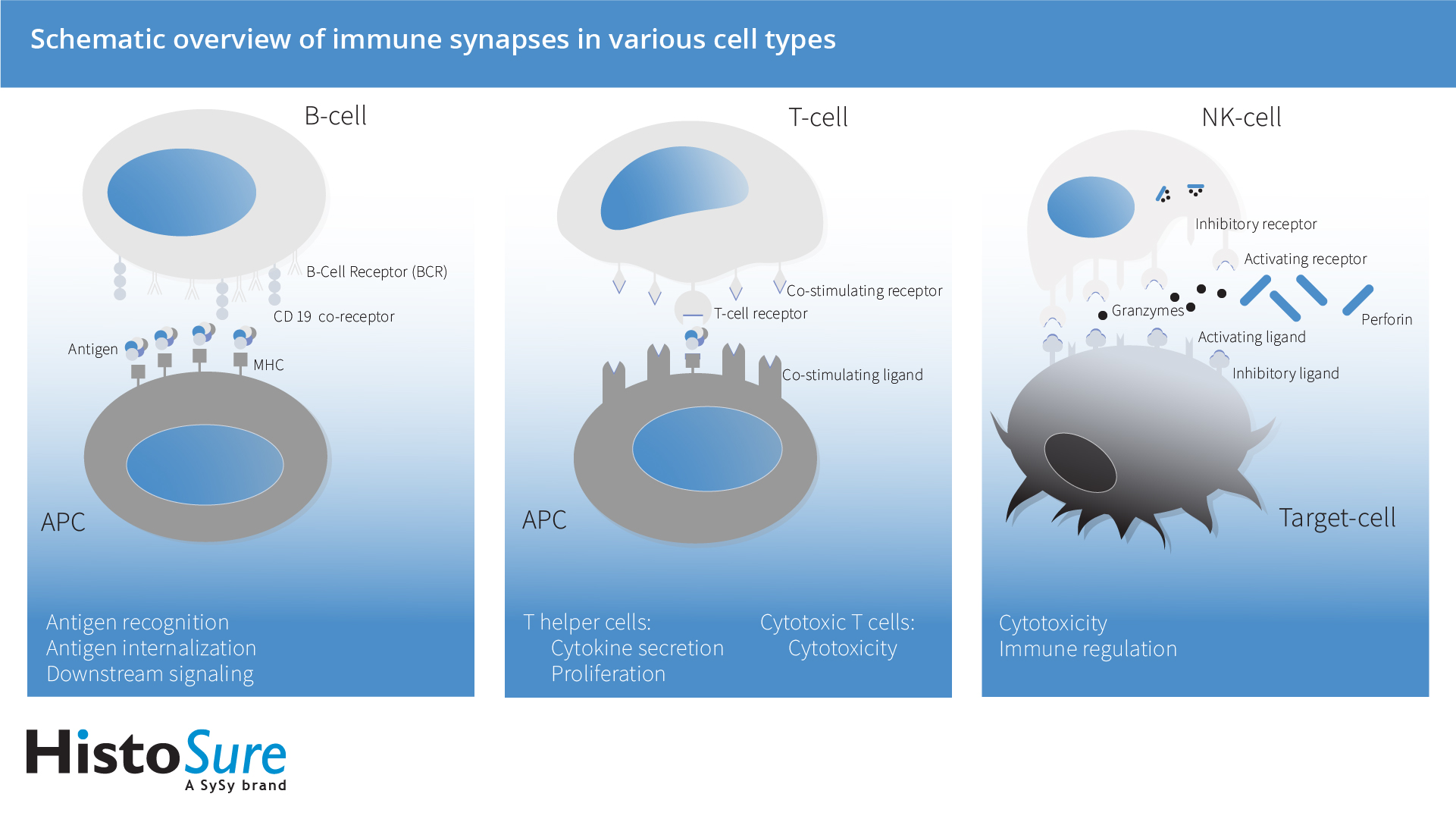
图 2: 免疫突触在多种细胞类型中的概述示意图
CD86 (分化群86,也被称为B7.2) 属于免疫调节细胞表面蛋白配体的B7家族,在未活化B细胞、树突状细胞和巨噬细胞中仅有低水平表达。激活导致CD86表达增强(Collins et al., 2005)。CD86和与其遗传上紧密相关的CD80蛋白(也被称为B7.1)由抗原呈递细胞表达,并通过与T细胞表达的CD28和细胞毒性T淋巴细胞抗原4 (CTLA-4, CD152)的相互作用,为T细胞活化和耐受性提供了所必需的共刺激信号。CD28 的结合可引起T细胞活化(Sansom et al. 2000),而CTLA-4 的结合会抑制T 细胞的响应,并作为T细胞活化的负调控因子。CD28的超级家族成员PD-1也可以与其配体PD-L1结合,来对T细胞活化进行负调控(Brunner-Weinzierl et al., 2018)。CD80 和CD86 在免疫调控中有不同效用:CD86 是T调节细胞(Tregs)增殖和存活的主要配体(Halliday et al., 2020)。跟CD80相比,CD86在增强T细胞杀伤能力上显示出了非常高的效率(Thiel et al., 2010)。
弓形虫是一种细胞内原生动物寄生虫,它不仅可以感染大脑,也可以感染其他器官,特别是肝脏。肝脏感染的特征是单核炎症细胞的多病灶聚集(Fernández-Escobar et al., 2021)。在小鼠中,弓形虫感染可以上调CD86在单核细胞、巨噬细胞和树突状细胞中的表达,但不能上调CD80的表达(Fischer et al., 1999)。
在感染的初期急性期,使用免疫细胞标记物IBA-1、CD86、CD11b 和Chil3,对初次试验的对照小鼠和被弓形虫感染的小鼠的肝脏切片分别进行免疫组化染色。在被弓形虫感染的小鼠肝脏中,发现IBA1阳性巨噬细胞高度浸润,以及CD86+、CD11b+ 和 Chil3+细胞的多病灶聚集。而在初次实验的对照小鼠中,IBA-1 染色主要是库佛氏细胞,很少检测到CD86阳性抗原呈递细胞(APCs)。并且对照小鼠肝脏中的CD11b和Chil3的阳性,也仅限于少数来源于CD11b+骨髓的单核细胞或来源于Chil3+的中性粒细胞(图3)。
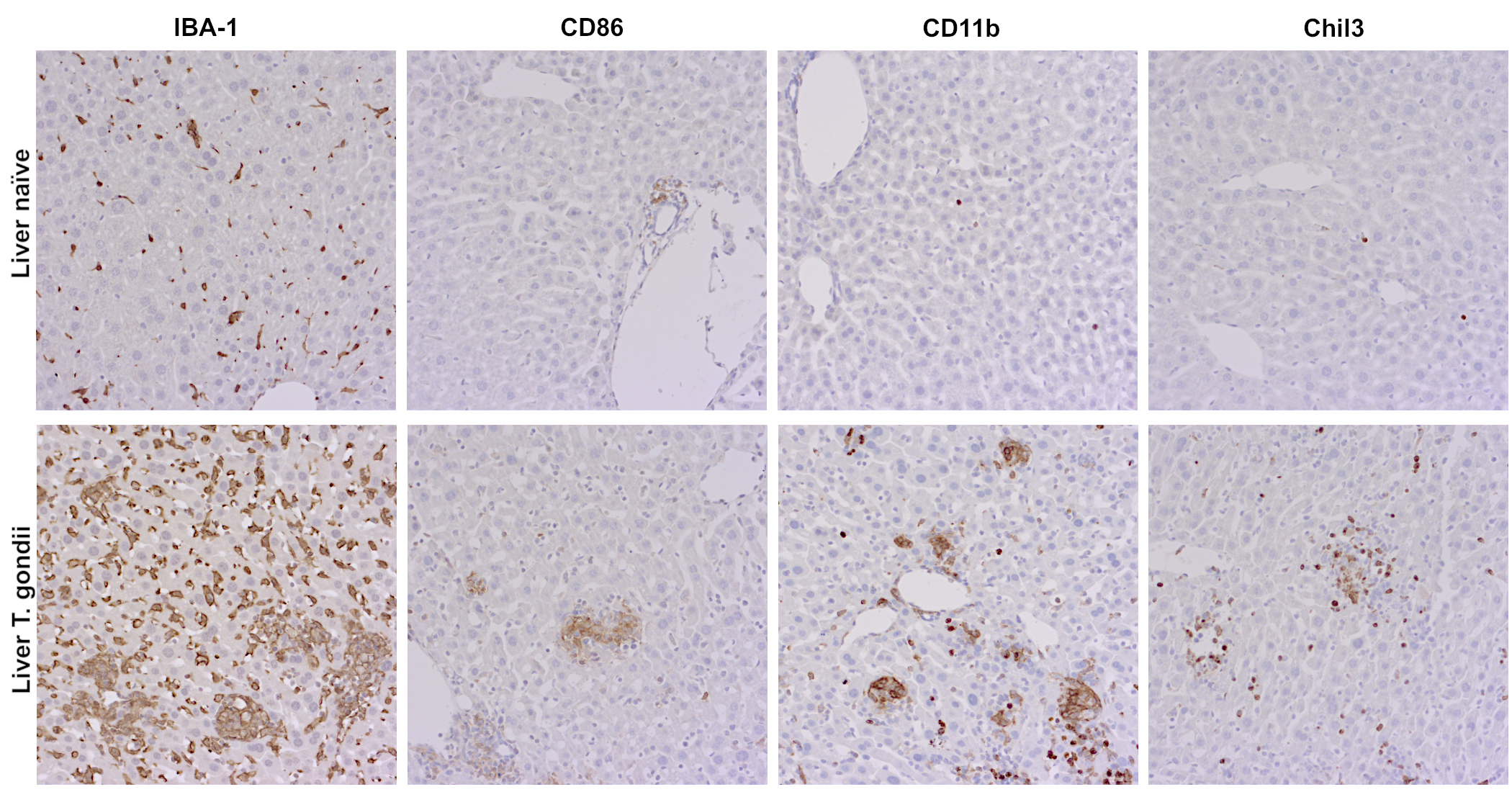
图3:用经福尔马林固定、石蜡包埋的初次实验的对照小鼠(上行)和受弓形虫感染的小鼠肝脏(下行)切片,进行IBA-1 (HS-234 017, 1:100)、CD86 (HS-466 003, 1:400)、CD11b (HS-384 117, 1:100) 和Chil3 (HS-442 017, 1:1000)的免疫组化检测。
用小鼠巨噬细胞标记物F4/80 和CD11b 对肝脏切片进行免疫荧光双染色,来检测对照小鼠和受弓形虫感染的小鼠肝脏中的F4/80high CD11b细胞。然而,仅在受弓形虫感染的小鼠肝脏中的单细胞团中检测到了F4/80low CD11b+ 细胞(图 4)。F4/80+ CD11b- 染色可识别库佛氏细胞,而F4/80low CD11b+ 染色可以刻画例如炎症条件下募集的单核细胞源性的巨噬细胞(见:mouse resident macrophages)。
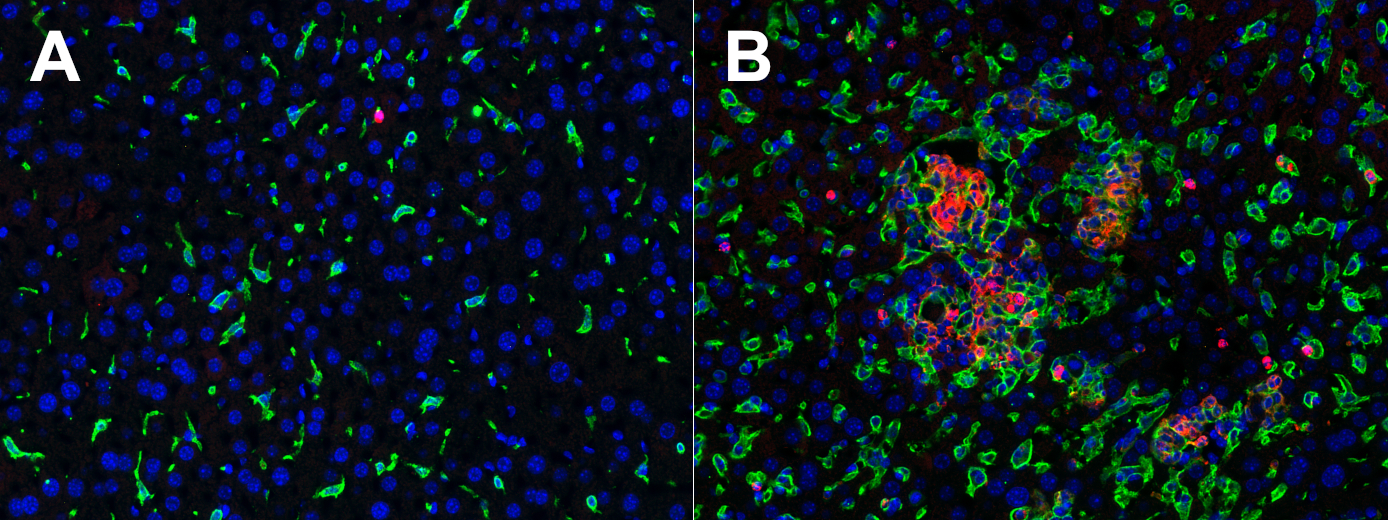
图4:使用兔抗F4/80 (cat. no. HS-397 008, 1:100; 绿色) 和大鼠抗CD11b (cat. no. HS-384 117, 1:100; 红色)抗体,对经福尔马林固定、石蜡包埋的对照小鼠(A)和受弓形虫感染的小鼠(B)的肝脏切片进行间接免疫染色。细胞核由DAPI 染色可见为蓝色。
免疫荧光双染色显示,在受弓形虫感染的小鼠肝脏单核细胞团中,CD86的表达主要在F4/80low or F4/80- 细胞中增强,使这些细胞成为活化的抗原呈递细胞(图5)。
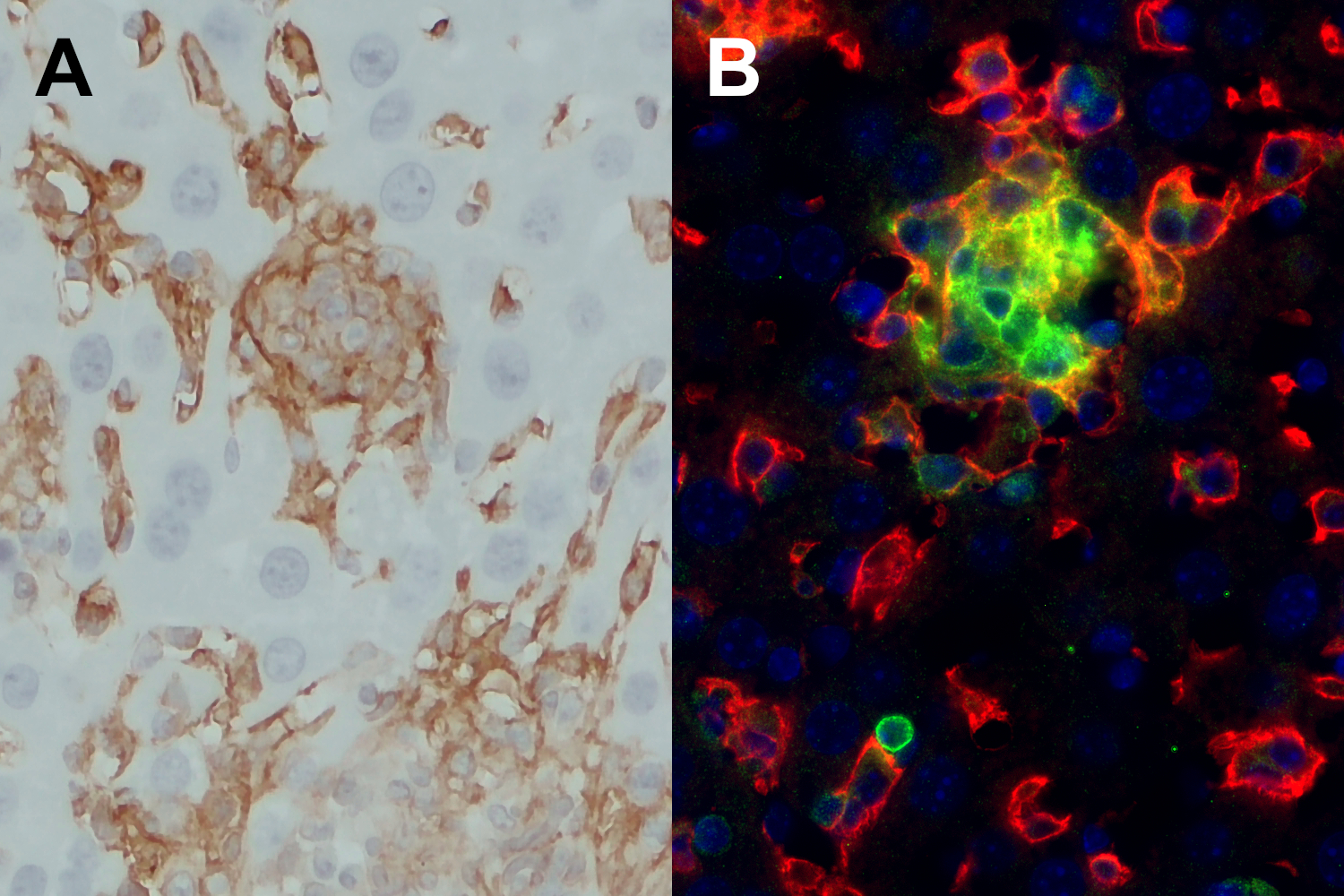
图5:A:用经福尔马林固定、石蜡包埋的受弓形虫感染的小鼠肝脏切片 ,进行了F4/80 (HS-397 008, 1:100)的免疫组化检测,在细胞团中发现了少量F4/80细胞。B:使用大鼠抗F4/80 (cat. no. HS-397 017, 1:100; 红色) 和兔抗CD86 (cat. no. HS-466 003, 1:200; 绿色),对经福尔马林固定、石蜡包埋的受弓形虫感染的小鼠肝脏切片进行间接免疫染色。细胞核由DAPI 染色可见为蓝色。
使用T细胞标记物CD3e (T 细胞系标记物)、CD4 (T 辅助细胞) 或者CD8a (细胞毒性T 细胞),通过对小鼠肝脏切片进行免疫组化染色,可以发现在受弓形虫感染的小鼠肝脏中,CD4+ T 辅助细胞的大量浸润及CD8+ 细胞毒性T 细胞的浸润(图6)。
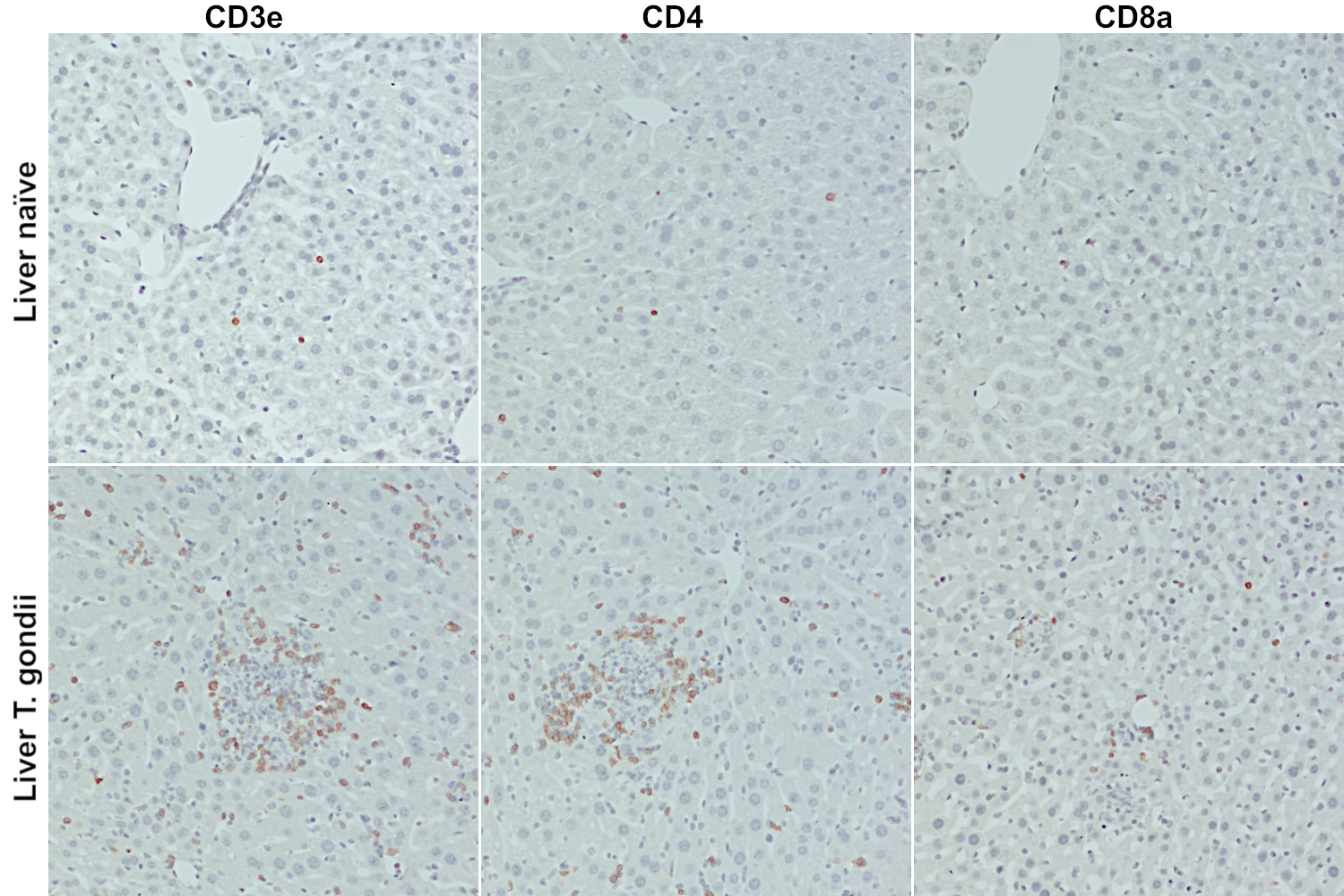
图 6:用经福尔马林固定、石蜡包埋的对照小鼠(上行)或受弓形虫感染的小鼠(下行)的肝脏切片,对T细胞标记物CD3e (HS-413 108, 1:100)、CD4 (HS-360 117, 1:100) 和CD8a (HS-361 003, 1:100)进行了免疫组化检测。
T 细胞免疫对于感染弓形虫的宿主存活来说至关重要。CD4+ T 细胞对于早期γ 干扰素的生成很重要。CD8+ T 细胞被认为是对抗这种寄生虫的主要效应细胞(Casciotti, 2002)。用CD4 和CD86 对感染弓形虫的小鼠肝脏切片进行免疫荧光双染色后,发现 CD4+ 辅助T细胞在单核细胞团中与CD86 阳性抗原呈递细胞(APCs)密切接触,从而形成免疫突触(图 7)。
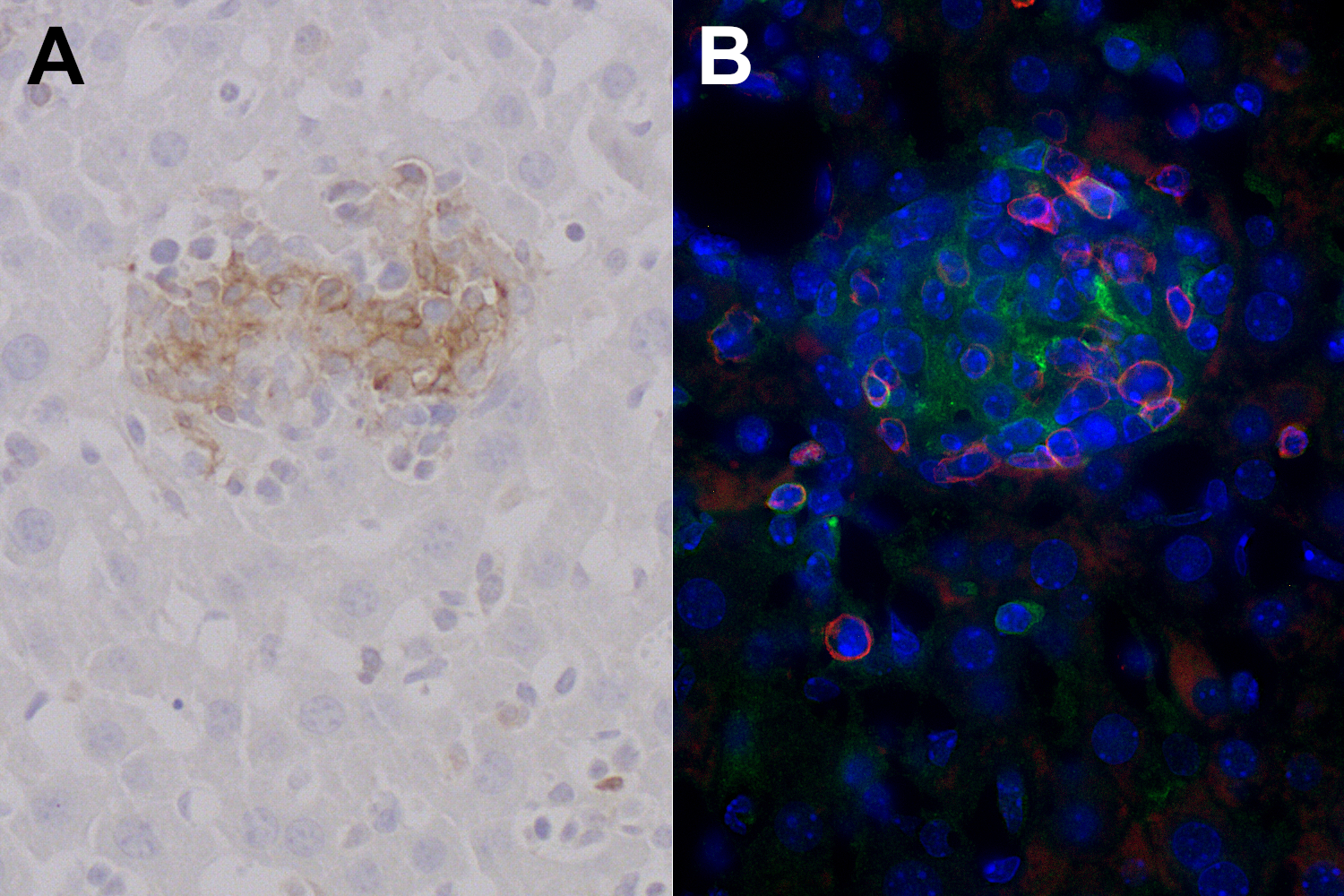
图7:A:用经福尔马林固定、石蜡包埋的受弓形虫感染的小鼠肝脏切片,进行CD86 (cat. no. HS-466 003, 1:400)的免疫组化检测 ,发现了细胞团中的CD86阳性细胞。 B: 使用大鼠抗CD4 (cat. no. HS-360 117, 1:100; 红色) 和兔抗CD86 (cat. no. HS-466 003, 1:200; 绿色)抗体,对经福尔马林固定、石蜡包埋的受弓形虫感染的小鼠肝脏切片进行间接免疫染色。细胞核由DAPI 染色可见为蓝色。
T细胞与抗原呈递细胞(APCs)接触部位的超分子组织在1998年被发现(Monks et al., 1998)。免疫突触的关键分子不仅覆盖在界面上,也组织分布在界面的不同区域(图 8)。这些区域被称为超分子活化复合物(SMACs) (reviewed in Huppa et al., 2003)。超分子活化复合物的中心区域(cSMAC)在T细胞位点富集T细胞受体(TCRs)和共刺激受体(CD28, CTLA-4),在抗原呈递细胞(APC)位点富集多肽-主要组织相容性复合体(pMHC)和B7配体(CD86, CD80)。超分子活化复合物的中心区域(cSMAC)被认为是信号终止和受体循环的位点(Verboogen et al., 2016)。细胞粘附分子如ICAM-1或粘附分子白细胞功能相关分子-1 (LFA-1)位于超分子活化复合物的中心区域(c-SMAC)周围的环状结构中,被称为外周超分子活化复合物(p-SMAC)。这些细胞粘附分子为免疫突触提供了机械支架。而大分子CD43和CD45则位于更远端的区域,称为dSMAC。在细胞毒性T细胞和NK细胞中发现的分泌突触中,溶菌颗粒的释放发生在超分子活化复合物的中心区域(cSMAC)的另一个结构域:分泌结构域 (Watanabe et al., 2018)。
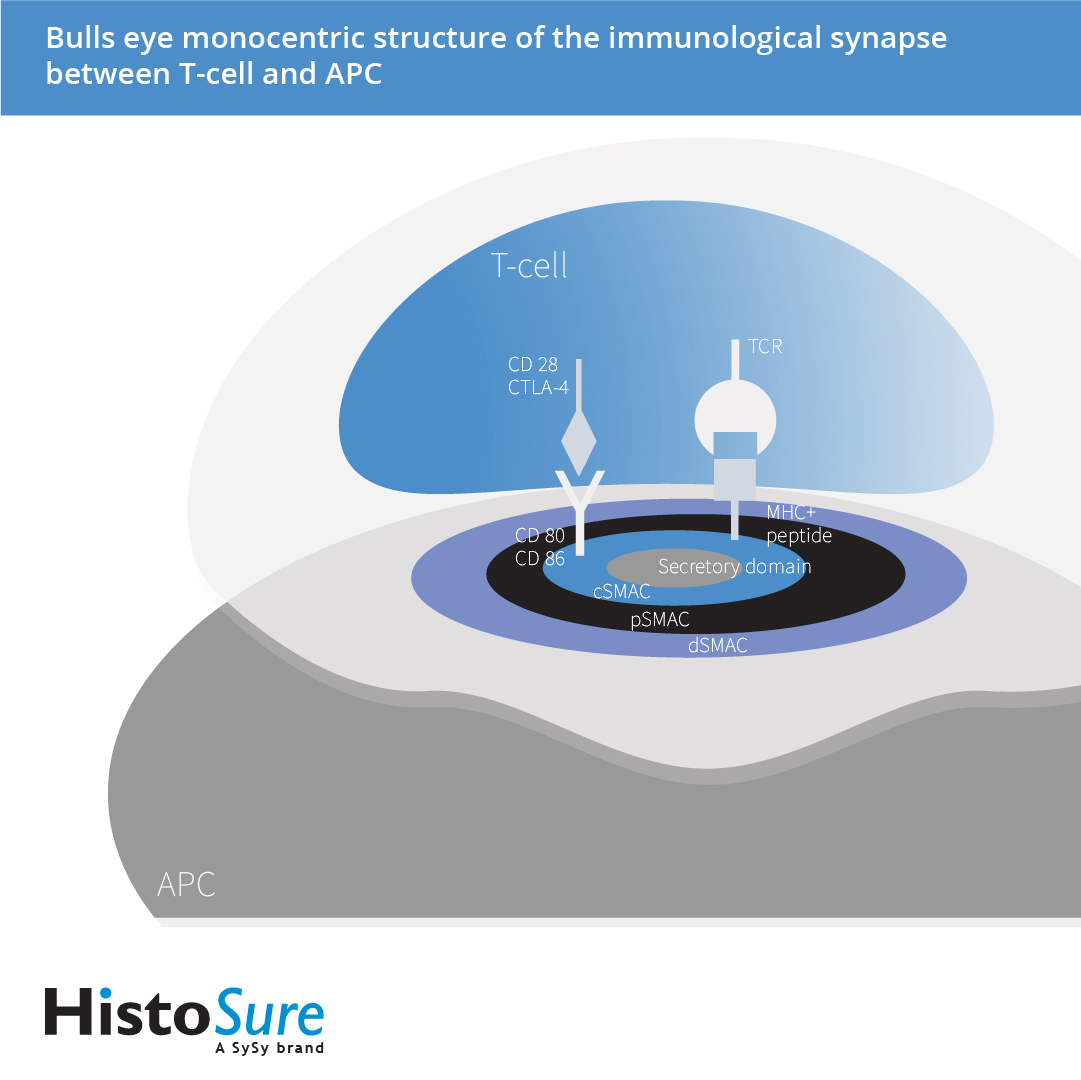
图8:T细胞和抗原呈递细胞(APC)之间免疫突触的牛眼单中心组织
| Cat. No. | Product Description | Application | Quantity | Price | Cart |
|---|
HS-384 117 | CD11b, rat, monoclonal, purified IgG IgG mouse specific | WB IHC IHC-P IHC-Fr | 200 µl | US$420.00 | |
HS-413 108 | CD3e, rabbit, monoclonal, recombinant IgGrecombinant IgG mouse specific | IHC IHC-P | 100 µl | US$420.00 | |
HS-360 117 | CD4, rat, monoclonal, purified IgG IgG mouse specific | WB IHC IHC-P IHC-Fr | 200 µl | US$420.00 | |
HS-466 003 | CD86, rabbit, polyclonal, affinity purifiedaffinity mouse specific | WB IHC IHC-P IHC-Fr | 50 µg | US$375.00 | |
HS-361 003 | CD8a, rabbit, polyclonal, affinity purifiedaffinity mouse specific | WB IHC IHC-P IHC-Fr | 200 µl | US$380.00 | |
HS-442 017 | Chil3, rat, monoclonal, purified IgG IgG mouse specific | WB ICC IHC IHC-P | 100 µg | US$420.00 | |
HS-397 008 | F4/80, rabbit, monoclonal, recombinant IgGrecombinant IgG | WB IHC IHC-P | 100 µl | US$420.00 | |
HS-397 017 | F4/80, rat, monoclonal, purified IgG IgG | WB IHC IHC-P IHC-Fr | 200 µl | US$420.00 | |
HS-234 017 | IBA1, rat, monoclonal, purified IgG IgG | WB ICC IHC IHC-P | 200 µl | US$420.00 |
致谢:我们感谢来自德国马格德堡奥托-冯-格里克大学,健康校园免疫学、传染病学和炎症,炎症和神经退化研究所的Henning Peter Düsedau博士,为我们提供了受弓形虫感染和对照小鼠的FFPE组织。
Orange, 2008. Formation and function of the lytic NK-cell immunological synapse. PMID: 19172692
Collins et al., 2005. The B7 family of immune-regulatory ligands. PMID: 15960813
Dustin 2014. The immunological synapse. PMID: 25367977
Friedl et al., 2004. Diversity in immune-cell interactions: states and funtions of the immunological synapse.
PMID: 15450978
Mastio et al. 2020. Higher Incidence of B Cell Malignancies in Primary Immunodeficiencies: A Combination of Intrinsic Genomic Instability and Exocytosis Defects at the Immunological Synapse. PMID: 33240268
Kuokkanen et al., 2015. Molecular Control of B Cell Activation and Immunological Synapse Formation.
PMID: 25639463
Waldhauer et al., 2008: NK cells and cancer immunosurveillance. PMID: 18836474
Collins et al., 2005. The B7 family of immune-regulatory ligands. PMID: 15960813
Sansom et al., 2000. CD28, CTLA-4 and their ligands: who does what and to whom? PMID: 11012769
Brunner-Weinzierl et al., 2018: CTLA-4 and PD-1 Control of T-Cell Motility and Migration: Implications for Tumor Immunotherapy. PMID: 30542345
Halliday et al., 2020. CD86 Is a Selective CD28 Ligand Supporting FoxP3+ Regulatory T Cell Homeostasis in the Presence of High Levels of CTLA-4. PMID: 33363541
Thiel et al., 2010. Efficiency of T-cell costimulation by CD80 and CD86 cross-linking correlates with calcium entry. PMID: 19824921
Fernández-Escobar et al., 2021. In vivo and in vitro models show unexpected degrees of virulence among Toxoplasmose gondii type II and III isolates from sheep. PMID: 34112256
Fischer et al., 1999. Differential CD86/B7-2 expression and cytokine secretion induced by Toxoplasma gondii in macrophages from resistant or susceptible BALB H-2 congenic mice. PMID: 10221646
Casciotti et al., 2002. CD8+-T-Cell Immunity against Toxoplasma gondii Can Be Induced but Not Maintained in Mice Lacking Conventional CD4+ T Cells. PMID: 11796568
Monks et al., 1998. Three-dimensional segregation of supramolecular activation clusters in T cells. PMID: 9738502
Huppa et al., 2003: T-cell-antigen-recognition and the immunological synapse. PMID: 14647479
Verboogen et al. 2015. The dendritic cell side of the immunological synapse. PMID: 26741354
Watanabe et al., 2018. Expanding the Therapeutic Window for CAR T Cell Therapy in Solid Tumors: The Knowns and Unknowns of CAR T Cell Biology. PMID: 30416506