
CD11c Histosure 抗体
CD11c 是一种广泛应用树突状细胞的标志物(参考CD11c 蛋白和功能)。它可被用来区分免疫系统中树突状细胞的亚型(参考CD11c在人类和鼠类免疫系统中的表达),但是CD11c 对树突状细胞可能不仅仅是一个标志物(参考 CD11c和炎症)。此外, CD11c也被用以癌症研究和诊断(参考 CD11c 在正常和组织中的表达)。
HistoSure 提供两种多克隆抗体产品,用于小鼠器官的石蜡包埋切片和经PFA固定的振动切片中CD11c的检测:
• HS-375 003 多克隆兔纯化抗小鼠CD11c抗体
• HS-375 004 多克隆豚鼠抗小鼠CD11c抗血清
HistoSure CD11c 抗体是小鼠特异型,即它们不会跟人类CD11c发生交叉反应,因此在人源化小鼠模型中,特别适合从人类细胞中区分鼠类。当然,与我们所有HistoSure抗体的质量方针一致,CD11c 抗体也在大量经福尔马林固定、石蜡包埋的组织样本中经过了广泛、全面的测试。
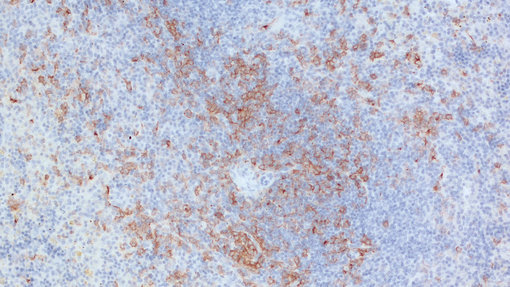
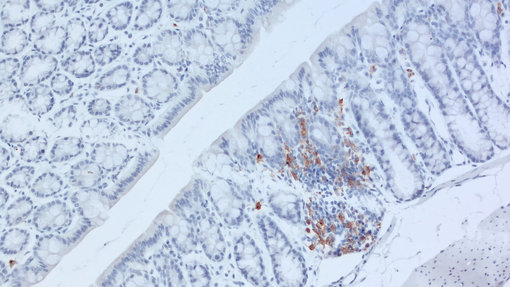
图 1: 使用豚鼠抗CD11c (HS-375 004, 1:1000; DAB)抗体,对鼠类经福尔马林固定,石蜡包埋的小鼠脾脏切片进行免疫组化染色。细胞核被苏木精复染为蓝色。
图2: 使用兔抗CD11c (HS-375 003, 1:100; DAB)抗体,对鼠类经福尔马林固定,石蜡包埋的小鼠结肠切片进行免疫组化染色。细胞核被苏木精复染为蓝色。
CD11c 是一种约150 kDa的I型跨膜糖蛋白,是补体受体4 (CR4)的一部分。与CR3一起,也被称为Mac-1 或者CD11b/CD18,CR4 属于黏附分子的β2 整合素家族。CR3和CR4 构成异质二聚体整合膜蛋白,分别由一条CD18 β链 (β2) 和一条整合素α M链 (ITGAM, CD11b) 或者一条整合素α X 链 (ITGAX, CD11c)组成。CR3和CR4 具有重叠配体结合特异性,其胞外结构域分享87%的序列同源性(Corbi et al., 1988)。补体受体为细胞功能及可溶性成分、因子和其他相关蛋白质之间建立了一个重要的链接。因此, CR3和CR4能够结合多种配体,如纤维蛋白原或肝素(Vorup-Jensen et al., 2018)。此外,CR3和CR4都与细胞黏附、迁移及吞噬作用相关。然而,虽然CR3参与了iC3b 调理菌的吞噬作用,但CR4主导细胞黏附于人类单核细胞衍生的巨噬细胞和树突状细胞的纤维蛋白原上(Sándor et al., 2016; Lukácsi et al., 2017)。最新数据表明应激条件下,CD11c对造血干细胞和祖细胞(HSPSs) 的调节扮演着重要的角色(Hou et al., 2020)。
CD11c 通常被用作小鼠树突状细胞的标记物。然而,CD11c不仅限于树突状细胞(DCs),也可被其它免疫细胞表达,例如肺泡中的巨噬细胞 (Gonzalez-Juarrero et al., 2003)和脂肪组织(Brake et al., 2006)。在人体中,单核细胞和树突状细胞都可以表达CD11c(Collin et al., 2012)。而在肠道巨噬细胞中(reviewed in Gross et al., 2015),炎症中的嗜中性粒细胞亚群中(Rosales, 2018),B细胞的一小部分,主要在自身免疫性疾病,如风湿性关节炎或多发性硬化症中(Golinski et al., 2020),自然杀伤细胞及T细胞亚群中,也检测到CD11c的表达。在患病的大脑中,活化的小神经胶质细胞也可表达CD11c (reviewed in Benmamar-Badel et al., 2020)。此外,在小鼠的短期造血干细胞及祖细胞中,也检测到CD11c的表达(Hou et al., 2020)。在肿瘤学中,CD11c对诊断毛细胞白血病(Maitre et al., 2019),急性骨髓性白血病(Master et al., 1989) 和一些慢性淋巴细胞性白血病(Umit et al., 2017)是一个重要的标记物。
树突状细胞(DC) 是指在血液、上皮和淋巴组织中发现的源于骨髓细胞的异质群体。树突状细胞与病原体识别密切相关,它可以指导免疫反应的特异性、强度和极性(Collin et al., 2012)。根据其表型,细胞因子分泌,组织分布及功能,人和小鼠树突状细胞可被分为不同亚群。
在小鼠中,最初时不同的树突状细胞亚型比人类树突状细胞亚型间更明显。因为标记物的表达并不存在于人类树突状细胞中。‘成年’小鼠树突状细胞可表达CD11c 和共刺激分子CD80, CD86 和CD40,它们具有中等到高水平的MHC II类(Shortman et al., 2002)。因此,CD11c通常被用作小鼠树突状细胞标记物。然而,由于CD11c并不限于树突状细胞,所以其他标记物的共染色是有用的。此外,也有证据表明:在鼠类树突状细胞中,CD11c的表达受不同刺激响应的调控。因此,活化的小鼠树突状细胞可能会瞬间体内CD11c阴性,从而会阻碍这些细胞的识别(Singh-Jasula et al., 2013)。
在鼠类淋巴组织中,树突状细胞(DCs)由至少三个主要群体组成:CD11c+ CD45R (B220)+ 浆细胞样树突状细胞 (pDCs),也叫“生产I型干扰素的天然细胞”,还有两个普通的树突状细胞亚型(cDCs),称作CD11c+ CD8a+ CD103+ cDC1s 和CD11c+ CD11b+ CD4+ cDC2s (Onai et al., 2007; Singh-Jasuja et al., 2013; Schlitzer et al., 2015)。此外,鼠类浆细胞样树突状细胞可根据表面标记物CD45RA、Ly-6C、Siglec-H 和CD317 (BST2) 的表达,而与普通树突状细胞(cDCs)区分出来(Musumeci et a., 2019)。鼠类普通树突状细胞(cDCs)和浆细胞样树突状细胞(pDCs)源于一个共同的c-Kitint Flt3+ M-CSFR+祖细胞(Onai et al., 2007)。
浆细胞样树突状细胞(pDCs) 可以主要通过Toll样受体(TLRs),高效感知细胞内病毒或自身DNA和RNA。它可以快速生成大量I 型和III 型干扰素(IFNs) ,因此在抗病毒免疫和全身自身免疫中扮演着重要的角色。
cDC1s可以对CD8+ T-细胞高效交叉呈递抗原,并且通过生成高水平的IL-12p70而提升细胞毒性 T 细胞和Th1细胞反应。而cDC2s 在MHCII抗原呈递和支持Th1、TH2 和 Th17极化上占据优势(reviewed in Musumeci et al., 2019)。
朗科汉斯细胞 (LC) 跟其它树突状细胞(DC)亚型相比,它们的发育非常独特。上皮中的朗科汉斯细胞可以长期自我更新,是及其长寿的细胞。第二种朗科汉斯细胞群体,叫作短期朗克汉斯细胞(LCs),即在炎症条件下由Gr-1high 单核细胞发育而来 (Seré et al., 2012)。朗科汉斯细胞可表达CD11c、兰格汉蛋白(CD207)和一系列骨髓标记物,例如CD11b和CD205 ,并且可为CD8a低水平染色(Shortman et al., 2002, Seré et al., 2012)。
单核细胞来源的树突状细胞(mo-DCs),也被称为‘炎症性树突状细胞’,是由感染和炎症环境诱发的树突状细胞群体。他们被证明可以表达CD11c、Ly6C、F4/80、CCR2、DC-SIGN (CD209)、CD206、 FcɛRI和CD64 (FcγRI)。CD64+ moDCs和CD64+ cDCs都可在发炎的组织中检测到,但CD64+ moDCs 比CD64+ cDCs显示出了更强烈的炎症响应程序来消除病原体(Min et al., 2018)。
在人体中,所有的树突状细胞可表达高水平的MHC II型 (HLA-DR),并且缺乏典型的谱系标记物,例如CD3e,是T细胞的一种标记物,CD19和CD20,是 B细胞的标记物,还有CD56,是人体自然杀伤细胞的标记物。人类树突状细胞也分为三种主要树突状细胞亚型cDC1、cDC2 和pDC。人类cDCs相当于鼠类CD11c+普通的树突状细胞(DCs),可表达典型的骨髓抗原例如CD11c、CD13、 CD33 和CD11b。这两种人类cDC亚型可通过CD141 (cDC1) 或者CD1 (cDC2)的表达来区分。 cDC1亚型在血液和组织中比cDC2 亚型更不常见(约占所有骨髓cDCs的10 %) ,并且它可以提升辅助性T细胞1型和自然杀伤细胞的响应。而cDC2 亚型可表达很多不同的凝集素,并且可提升广泛的免疫反应(Collin et al., 2013; Collin et al., 2018)。
pDCs 通常缺乏骨髓抗原,可以通过CD123 (IL-3R)、CD303 (BDCA2)、CD304 (BDCA4) 和 CD45RA的表达来区分。pDCs 具有一个非圆形的核和突出的内质网和高尔基体,因此类似一个浆细胞,最初在人类血液和扁桃体中被识别。像所有的人类树突状细胞(DCs)一样,它们可以表达CD4,但是比cDCs 更高一个水平。人类pDCs 对病毒感染有特异性感知和响应(Collin et al., 2013; Collin et al., 2018)。
人类朗格汉斯细胞(LCs)与cDC1细胞一样,对CD11c 表达低于cDC2细胞。人类朗科汉斯细胞可表达高水平的C型兰格汉蛋白、CD1a、E-cadherin和EpCAM。朗格汉斯细胞也可以保持上皮健康,并且可容忍共生体(Collin et al., 2018)。
人类单细胞来源的树突状细胞(mo-DCs)在炎症条件下被发现,例如皮肤致敏性、过敏性鼻炎或者乳糜泻。人类单核细胞已经可以表达CD11c 和MHCII,因此这些标记物对从树突状细胞(DCs)中区分单核细胞并没有帮助。单细胞来源的树突状细胞(Mo-DCs)有CD11c+、CD1c+、FcεR1+、CD206+ 和IRF4+。人类单细胞来源的树突状细胞(mo-DCs)可能主要在发炎的地方发挥作用,而不是转移到淋巴结(reviewed in Collin et al., 2018)。
| 树突状细胞类型 | 小鼠细胞标记物 | 人类细胞标记物 | 功能 |
| 浆细胞样树突状细胞(pDC) |
CD11clow (HS-375 003, HS-375 004) CD45R (B220), MHC class II, CD45RA, Ly-6C, Siglec-H, CD317 (BST2 / PDCA-1) |
CD123 (IL-3R), CD303 (BDCA2), CD304 (BDCA4), CD45RA, MHC II, | CD123 (IL-3R), CD303 (BDCA2), CD304 (BDCA4), CD45RA, MHC II |
| 传统树突状细胞1(cDC1) |
CD11chigh (HS-375 003, HS-375 004), CD8a (HS-361 003, HS-361 008,HS-361 017), CD103, MHC class II |
CD11c, CD141, CD11b (HS-384 017), MHC class II, CD13, CD33 | 提升细胞毒性T细胞和Th1细胞的响应 |
| 传统树突状细胞2(cDC2) |
CD11chigh (HS-375 003, HS-375 004), CD11b (HS-384 103, HS-384 117), CD4 (HS-360 004, HS-360 017, HS-360 108, HS-360 117, MHC class II |
CD11c, CD1, CD11b (HS-384 017), MHC class II, CD13, CD33 | 优越的抗原呈递能力;可诱导Th17响应 |
| 朗格汉斯细胞(LC) | CD11c (HS-375 003, HS-375 004), langerin (CD207) | CD11clow, CD1a, E-Cadherin, EpCAM | 保持表皮健康和对共生体的耐受性 |
| 单核细胞衍生的树突状细胞 |
CD11c (HS-375 003, HS-375 004), CD209, CD11b (HS-384 103, HS-384 117), Ly6C, CD64 |
CD11c, CD1c, CD206 | 消除病原体 |
| Cat. No. | Product Description | Application | Quantity | Price | Cart |
|---|
375-0P | CD11c, control peptidecontrol peptide | 100 µg | US$110.00 | ||
HS-375 003 | CD11c, rabbit, polyclonal, affinity purifiedaffinity mouse specific | WB IHC IHC-P | 200 µl | US$375.00 | |
HS-375 004 | CD11c, Guinea pig, polyclonal, antiserumantiserum mouse specific | WB IHC IHC-P | 100 µl | US$355.00 | |
HS-375 008 | CD11c, rabbit, monoclonal, recombinant IgGrecombinant IgG mouse specific | IHC IHC-P | 50 µg | US$420.00 | |
HS-375 017 | CD11c, rat, monoclonal, purified IgG IgG mouse specific | IHC IHC-P IHC-Fr | 100 µg | US$420.00 | |
HS-466 003 | CD86, rabbit, polyclonal, affinity purifiedaffinity mouse specific | WB IHC IHC-P IHC-Fr | 50 µg | US$375.00 | |
HS-516 003 | CX3CR1, rabbit, polyclonal, affinity purifiedaffinity | WB ICC IHC IHC-P | 50 µg | US$375.00 | |
HS-391 017 | LAMP3, rat, monoclonal, affinity purifiedaffinity K.O. | IHC-P | 100 µg | US$420.00 |
在初次试验的老鼠肝脏中,CD11c+ 细胞位于肝窦周围,这些细胞是CD11b-。在炎症条件下,肝脏经常发现炎症群集。这些群集包括T细胞、 CD11b+ 中性粒细胞、 单核细胞/巨噬细胞系细胞和CD11c+ 树突状细胞(Lloyd et al., 2008)。经口服灌胃而感染弓形虫囊肿的小鼠会发展为全身炎症,而在感染后14天,寄生虫甚至能穿过血脑屏障(French et al., 2019)。在受感染的小鼠肝脏中,可检测到炎症群集含有CD11c+ 细胞,但在特定无病原体(SPF)条件下的对照动物的肝脏中却没有(图3)。
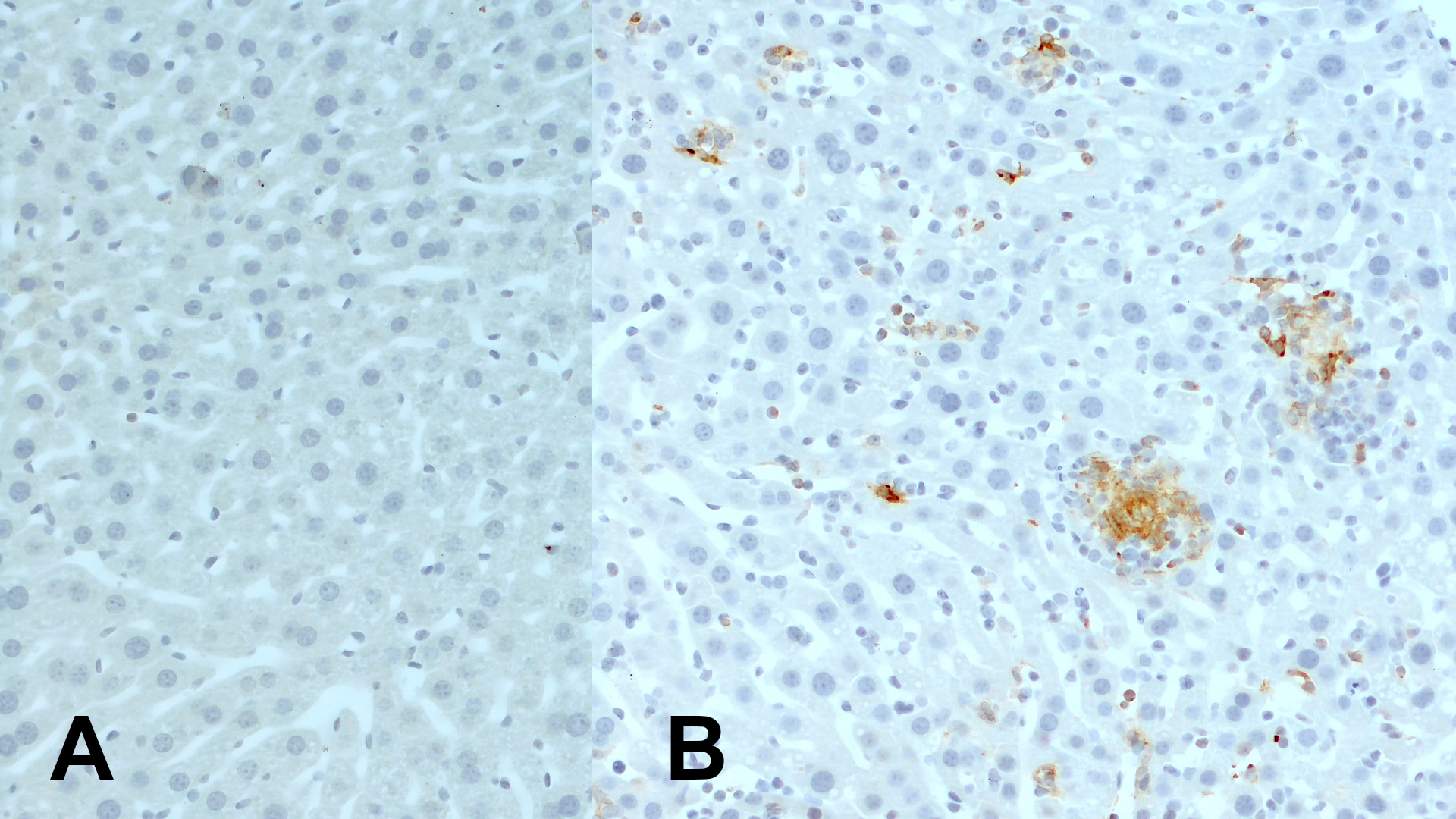
图3:使用兔抗CD11c (HS-375 003, 1:100; DAB)抗体,对经福尔马林固定,石蜡包埋的小鼠肝脏切片:(A) 对照小鼠;(B) 被弓形虫囊肿感染的小鼠 进行免疫组化染色。细胞核被苏木精复染为蓝色。
小神经胶质细胞是中枢神经系统(CNS)非常关键的免疫效应因子,不仅在大脑感染,也在维持中枢神经系统方面扮演极其重要的角色。在许多神经系统疾病中,包括炎症、去隨鞘和退化疾病,还有神经胶质瘤和损伤,小神经胶质细胞的活化是一种普遍特征。CD11c 的表达是小神经胶质细胞活化的标志物,并且在阿尔茨海默病(AD)的Aβ斑块周围存在CD11c+小神经胶质细胞,已在多项研究中被证明(reviewed in Benmamar-Badel et al., 2020)。而在APP/PS1 AD模型中,通过与小神经胶质细胞标志物IBA-1共染色,证实在斑块附近检测到了小神经胶质细胞CD11c 的表达(图4)。
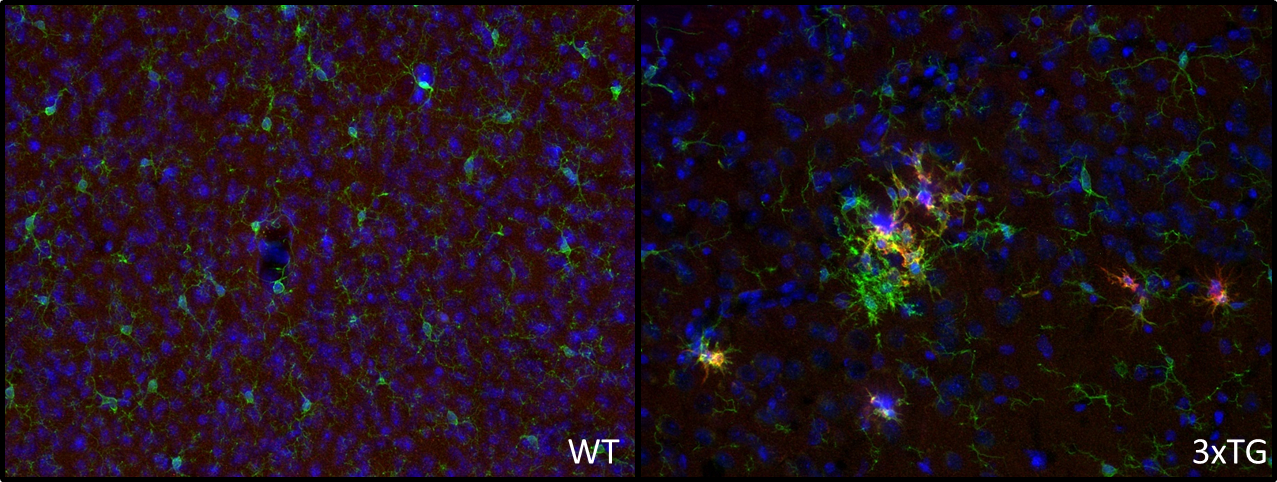
图4:使用豚鼠抗CD11c (cat. no. HS-375 004, 稀释比例 1 : 1000; 红色) 和兔抗IBA 1 (cat. no. HS-234 013, 稀释比例1 : 1000; 绿色)抗体,对经PFA固定的野生型小鼠(左)和三倍转基因阿尔兹海默症小鼠(右)的大脑皮层切片进行间接免疫染色。细胞核由DAPI 染色可见为蓝色。
由弓形虫引发的神经炎症与小神经胶质细胞活化的增长和多种免疫细胞亚型的浸润有关(French et al., 2019)。与此一致的是,在受弓形虫感染的小鼠大脑中也检测到了CD11c+ 细胞,但在未受感染的对照小鼠大脑中却没有(图5)。
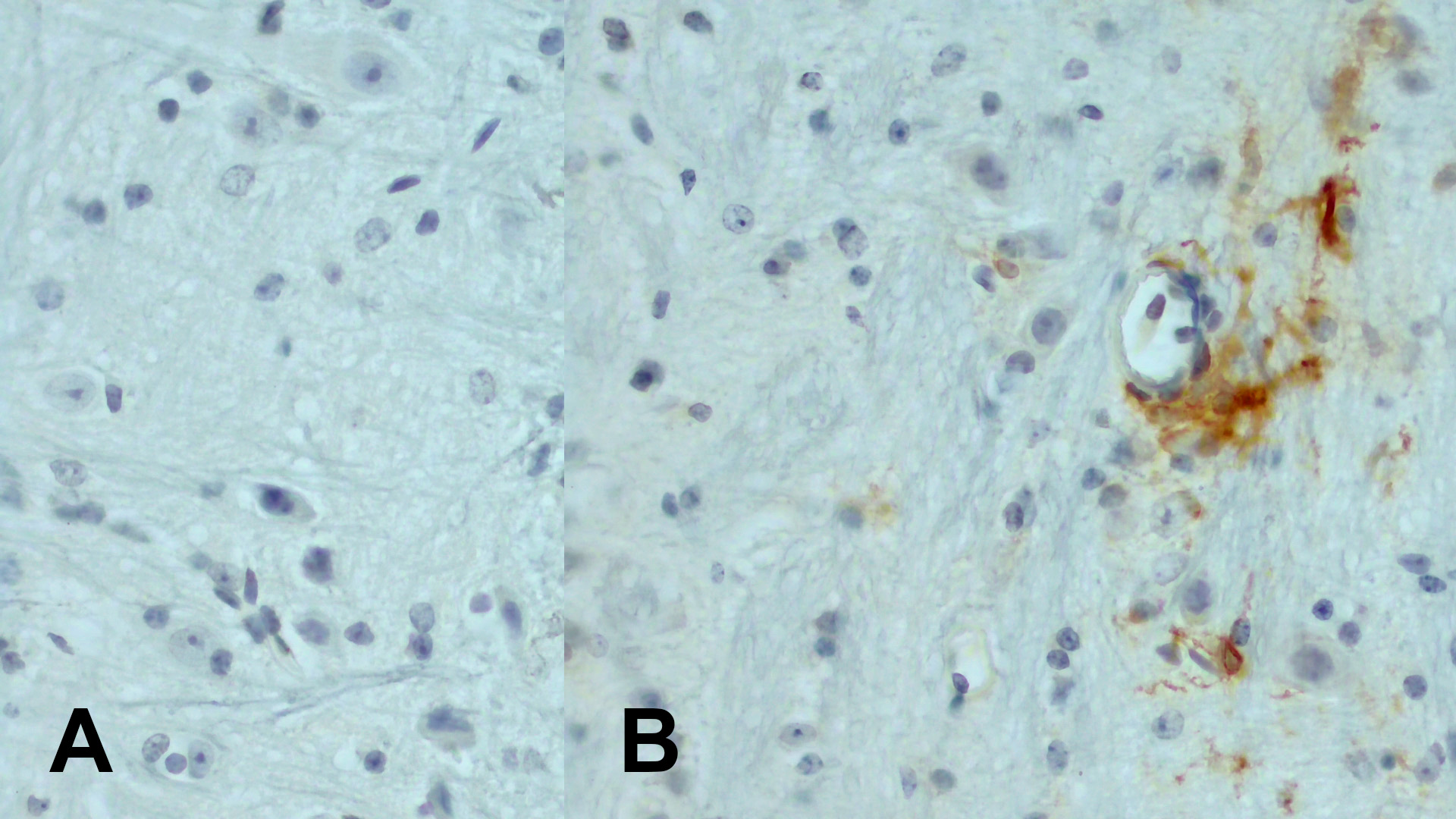
图5:使用豚鼠抗CD11c (HS-375 004, 1:1000; DAB)抗体,对经福尔马林固定、石蜡包埋的小鼠脑切片进行免疫组化染色。A:初次试验的对照小鼠;B:全身感染弓形虫的小鼠。细胞核被苏木精复染为蓝色。
抗原呈递对通过激发原始T细胞分化为效应细胞,诱导抗肿瘤免疫来说非常重要。当CD11c在人类单核细胞来源的和人类普通的树突状细胞中高度表达时,可以在人类肿瘤中发现CD11c+ 细胞,并且分布在肿瘤浸润淋巴细胞(TILs)数量较多的区域。因此,CD11c高表达与患者更长的中位总生存期相关,如:胃癌 (Wang et al., 2015) 或者高级别浆液性卵巢癌(Corvigno et al., 2020)。此外,同源小鼠模型实验中具有免疫活性的小鼠显示,CD11c+ 树突状细胞在抗体疗法中的杀瘤活动中起着关键的作用(Haynes et al., 2010)。因此,在同源小鼠模型中,CD11c+ 细胞的组织学检测在临床肿瘤学中是一个非常重要的生物标记物(图6)。
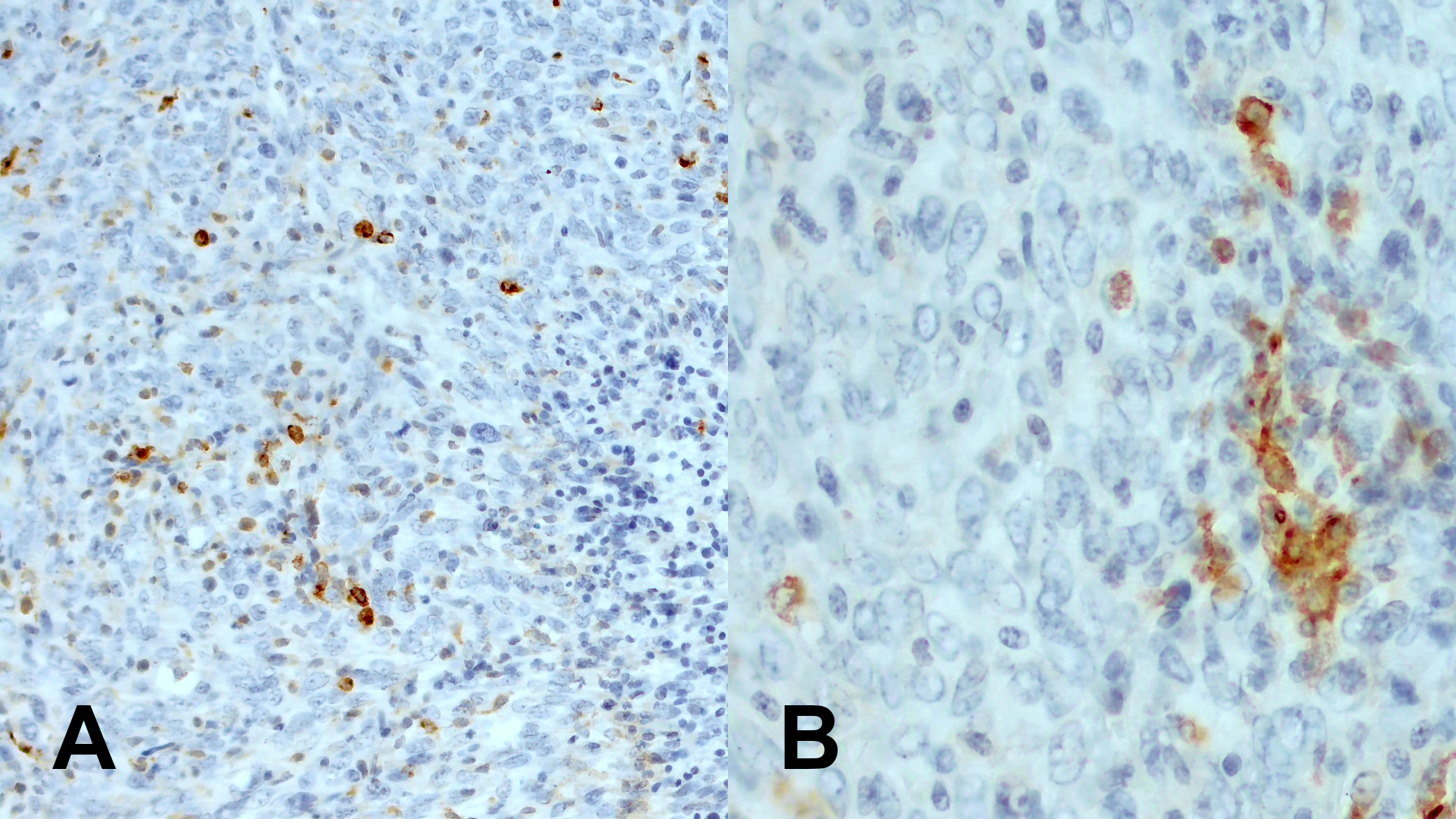
图6:使用A) 兔抗CD11c (HS-375 003, 1:100; DAB) 或者 B) 豚鼠抗CD11c (HS-375 004, 1:1000; DAB)抗体,对经福尔马林固定、石蜡包埋的小鼠乳腺癌切片(EMT6; 由Charles River友情提供,弗莱堡,德国)进行免疫组化CD11c 染色。细胞核被苏木精复染为蓝色。
Vorup-Jensen et al., 2018. Structural Immunology of Complement Receptors 3 and 4. PMID: 30534123
Collin et al., 2013. Human dendritic cell subsets. PMID: 23621371
Collin et al., 2018. Human dendritic cell subsets: an update. PMID: 29313948
Onai et al., 2007. Identification of clonogenic common Flt3+M-CSFR+ plasmacytoid and conventional dendritic cell progenitors in mouse bone marrow. PMID: 17922016
Singh-Jasuja et al., 2013. The mouse dendritic cell marker CD11c is down-regulated upon cell activation through Toll-like receptor triggering. PMID: 22445076
Gonzalez-Juarrero et al., 2003. Dynamics of macrophage cell populations during murine pulmonary tuberculosis. PMID: 12960339
Brake et al., 2006. ICAM-1 expression in adipose tissue: effects of diet-induced obesity in mice. PMID: 16807303
Shortman et al., 2002. Mouse and human dendritic cell subtypes. PMID: 11913066
Musumeci et al., 2019. What Makes a pDC: Recent Advances in Understanding Plasmacytoid DC Development and Heterogeneity. PMID: 31191558
Schlitzer et al., 2015. Identification of cDC1- and cDC2-committed DC progenitors reveals early lineage priming at the common DC progenitor stage in the bone marrow. PMID: 26054720
Seré et al., 2012. Two distinct types of Langerhans cells populate the skin during steady state and inflammation. PMID: 23159228
Min et al., 2018. Inflammation induces two types of inflammatory dendritic cells in inflamed lymph nodes. PMID: 29546878
Lloyd et al., 2008. Three-colour fluorescence immunohistochemistry reveals the diversity of cells staining for macrophage markers in murine spleen and liver. PMID: 18367204
French et al., 2019. Neuronal impairment following chronic Toxoplasma gondii infection is aggravated by intestinal nematode challenge in an IFN-γ-dependent manner. PMID: 31352901
Benmamar-Badel et al., 2020. Protective Microglial Subset in Development, Aging, and Disease: Lessons From Transcriptomic Studies. PMID: 32318054
Gross et al., 2015. Guardians of the Gut - Murine Intestinal Macrophages and Dendritic Cells. PMID: 26082775
Rosales, 2018. Neutrophil: A Cell with Many Roles in Inflammation or Several Cell Types? PMID: 29515456
Golinski et al., 2020. CD11c + B Cells Are Mainly Memory Cells, Precursors of Antibody Secreting Cells in Healthy Donors. PMID: 32158442
Maitre et al., 2019. Hairy cell leukemia: 2020 update on diagnosis, risk stratification, and treatment. PMID: 31591741
Master et al., 1989. Diagnostic application of monoclonal antibody KB90 (CD11c) in acute myeloid leukaemia. PMID: 2477088
Umit et al., 2017. CD11c expression in chronic lymphocytic leukemia revisited, related with complications and survival. PMID: 28603911
Hou et al., 2020. CD11c regulates hematopoietic stem and progenitor cells under stress. PMID: 33351105
Corbi et al., 1988. The human leukocyte adhesion glycoprotein Mac-1 (complement receptor type 3, CD11b) alpha subunit. Cloning, primary structure, and relation to the integrins, von Willebrand factor and factor B. PMID: 2457584
Sándor et al., 2016. CD11c/CD18 Dominates Adhesion of Human Monocytes, Macrophages and Dendritic Cells over CD11b/CD18. PMID: 27658051
Lukácsi et al., 2017. The role of CR3 (CD11b/CD18) and CR4 (CD11c/CD18) in complement-mediated phagocytosis and podosome formation by human phagocytes. PMID: 28554712
Wang et al., 2015. High expression of CD11c indicates favorable prognosis in patients with gastric cancer. PMID: 26309367
Corvigno et al. 2020. High density of stroma-localized CD11c-positive macrophages is associated with longer overall survival in high-grade serous ovarian cancer. PMID: 33032823
Haynes et al. 2010. CD11c+ dendritic cells and B cells contribute to the tumoricidal activity of anti-DR5 antibody therapy in established tumors. PMID: 20505139