
· 人源化小鼠-定义
· 用于异种移植的免疫缺陷小鼠品系
· 用于人类癌症研究的小鼠模型
· 物种特异性抗体在人源化小鼠模型中的应用
· 产品
· 参考文献
人源化小鼠,此术语被定义为异种移植了人类细胞或者可表达人类基因产物细胞的小鼠。虽然实验小鼠可与人类共享大多数的蛋白编码基因 (Yue et al., 2014),但并不是小鼠生物学的所有方面都可反映人类生物学。最大的不同主要在例如:免疫系统的发育、活化和对挑战的响应 (Mestas et al., 2004)。此外,许多药品和人类病原体是物种特异的 (Walsh et al., 2017)。而在将很多理论发现转移到临床设置时也有很多限制因素。因此,更能如实概括人类生物学重要特征的动物模型已被开发,用来研究人类疾病包括癌症、过敏和移植物抗宿主病。
免疫缺陷小鼠可被广泛用于异种移植。目前已有大量先天性免疫缺陷或基因缺陷的转基因小鼠品系和亚品系。
无胸腺裸鼠是第一种先天性免疫缺陷小鼠,由于胸腺上皮的发育不全而缺乏成熟T细胞。然而,功能性B细胞和特别是自然杀伤细胞(NK)的存在限制了长期人类细胞移植的选择。而缺乏Jak3的无胸腺裸鼠(Nude-J)由于完全缺失自然杀伤细胞,可克服这些限制 (Panaampon et al., 2021)。
严重联合免疫缺陷(Scid)小鼠在 Prkdc基因中携带一个基因突变点(scid mutation)。该基因编码一个依赖于DNA的蛋白激酶(DNA-PK),参与 VDJ的重组和 DNA的损伤修复。这会影响T细胞和B细胞中抗原受体基因的体细胞重组,从而引起T淋巴细胞和B淋巴细胞在发育未全时期停止成熟。因此,严重联合免疫缺陷小鼠实际上缺失T淋巴细胞和B淋巴细胞,其血清中几乎不能检测到抗体滴度,但仍保留有自然杀伤细胞、巨噬细胞和粒细胞。仅有一小部分B细胞和T细胞存活,并在抗原接触后扩增。这种现象被称为“泄漏”(reviewed in Vladutiu, 1993)。非肥胖型糖尿病或者严重联合免疫缺陷杂交(NSG)小鼠品系由转移严重联合免疫缺陷基因突变到非肥胖型糖尿病(NOD)小鼠中产生,并且显示自然杀伤细胞活性及先天免疫能力会下降 (Belizàrio, 2009)。NOD-scid IL2rg -/-小鼠品系由NOD/Scid小鼠与缺乏IL2rg -/-的自然杀伤细胞交叉生成,并提高了在人类细胞移植中的有效性 (Belizàrio, 2009)。
RAG小鼠缺失rag1或rag2重组激活基因,该基因编码淋巴特异性蛋白,在T细胞和B细胞发育早期扮演着重要的角色。跟SCID小鼠类似,RAG小鼠缺乏成熟B淋巴细胞和T淋巴细胞,但不显示“泄露”现象。此外,RAG敲除动物在免疫系统的先天区室如巨噬细胞和粒细胞中显示出正常的造血功能 (Mombaerts et al., 1992; Shinkai et al., 1992)。
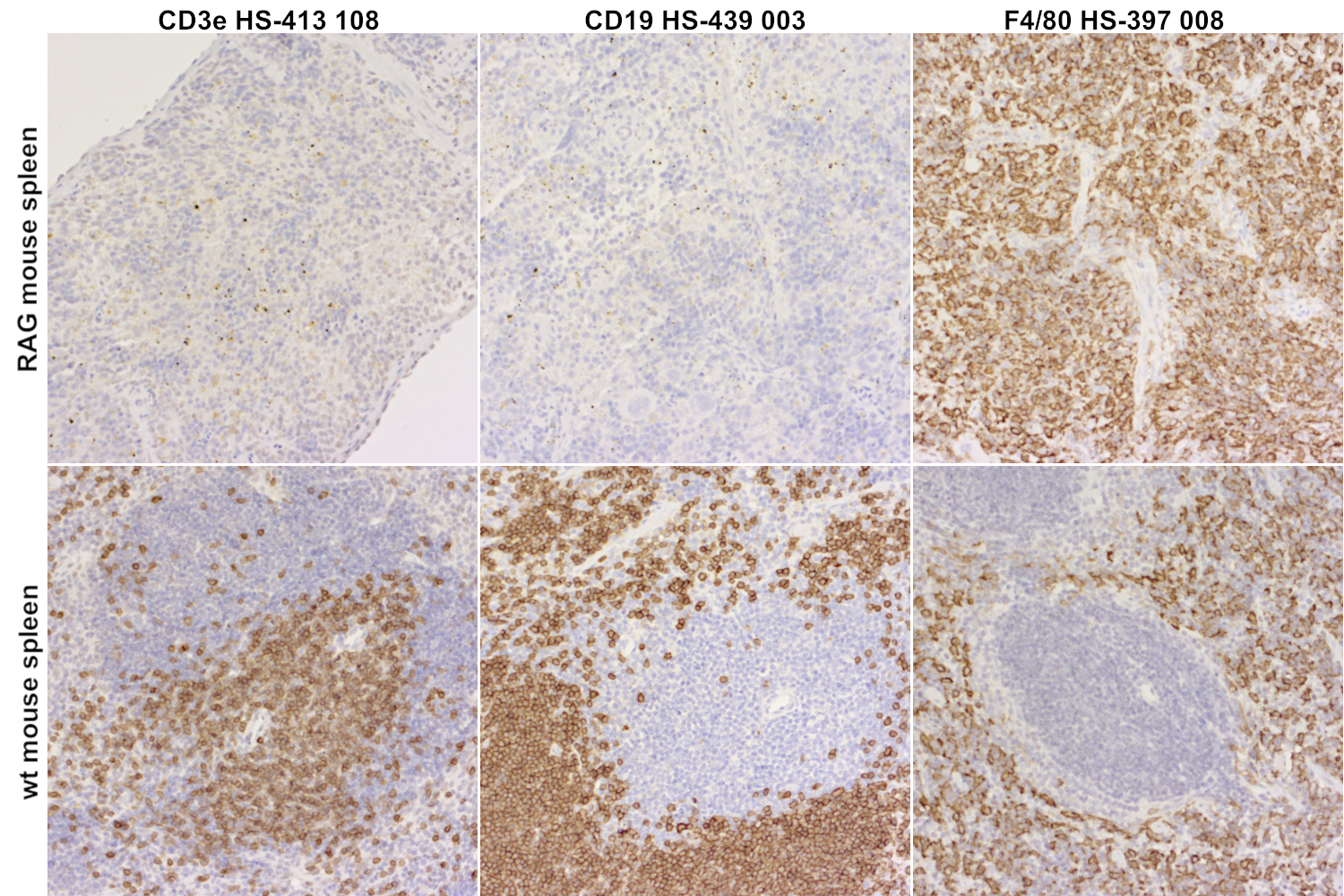
图1:Rag2/IL2rg 双重敲除小鼠和野生型小鼠脾脏中T 细胞、B 细胞和巨噬细胞的染色。对经福尔马林固定、石蜡包埋的Rag2/IL2rg双重敲除小鼠(上行)和野生型小鼠(下行)脾脏中T细胞标记物CD3e (HS-413 108, 1:100)、B细胞标记物CD19 (HS-439 003, 1:100)和巨噬细胞标记物F4/80 (HS-397 008, 1:100)进行免疫组织化学检测后发现,Rag2/IL2rg小鼠缺失成熟B淋巴细胞和T淋巴细胞。Rag2/IL2rg小鼠脾脏中仍有F4/80阳性巨噬细胞存在,然而,白髓和红髓的微组织结构已丢失。
细胞系来源的异种移植(CDX)模型,将人类细胞系注入到裸鼠或者Scid小鼠中,是抗癌药发展中测试药物功效最老的模型之一。癌细胞系提供了无限的生物材料来源。而驱动其表现型的潜在遗传异常已被很好地刻画。然而,CDX模型不能准确地模仿人类肿瘤的遗传异质性和肿瘤微环境 (Pan et al., 2022)。
在患者来源的异种移植(PDX)模型中,初级人类肿瘤样品移入NSG小鼠中。PDX模型可以更准确地代表参与先天肿瘤发育的复杂性,包括肿瘤异质性、肿瘤结构和微环境 (Olson et al., 2018)。肿瘤微环境包含肿瘤内皮细胞、癌症相关的纤维母细胞和肿瘤相关的巨噬细胞,可促进癌症进展和转移 (Koga et al., 2019)。PDX模型已被证明对抗癌药的发展是很有用的临床模型。此外,当从临床试验参与者的肿瘤中建立PDX模型时,可以在联合临床试验中用作“化身”模型。然而,由于这些动物中功能性免疫系统的缺失,PDX模型仅限于化学疗法药物,并不能用于实验性的免疫疗法。癌症免疫疗法的新方案例如非特异性免疫疗法、癌症疫苗、溶瘤病毒疗法、单克隆抗体、免疫检查点和T细胞疗法,都需要具有完整免疫系统的动物模型。当鼠类免疫系统不能准确反映人类生物学时,具有完整合格人类免疫系统的鼠类,对测试免疫治疗效用来说是更好的模型 (Choi et al., 2018)。
具有功能性人类免疫系统的人源化小鼠对研究人类免疫组分与人类癌细胞之间的相互作用来说,是非常强大的工具 (Tian et al., 2020)。人类免疫系统的重建需通过移植人类成熟的周边血液单核细胞(PBMCs)或者脐带人类CD34+细胞到免疫缺陷的小鼠中。转基因免疫缺陷小鼠的使用可表达人类生长因子,从而促进人类免疫数量的扩展 (Olson et al., 2018)。然而,大多数人源化癌症小鼠模型具有一个最大的限制是重建的人类免疫系统对接种的人类肿瘤是同种异体的。在一个理想的人源化PDX模式系统中,造血干细胞跟移入的肿瘤应是自体同源的。
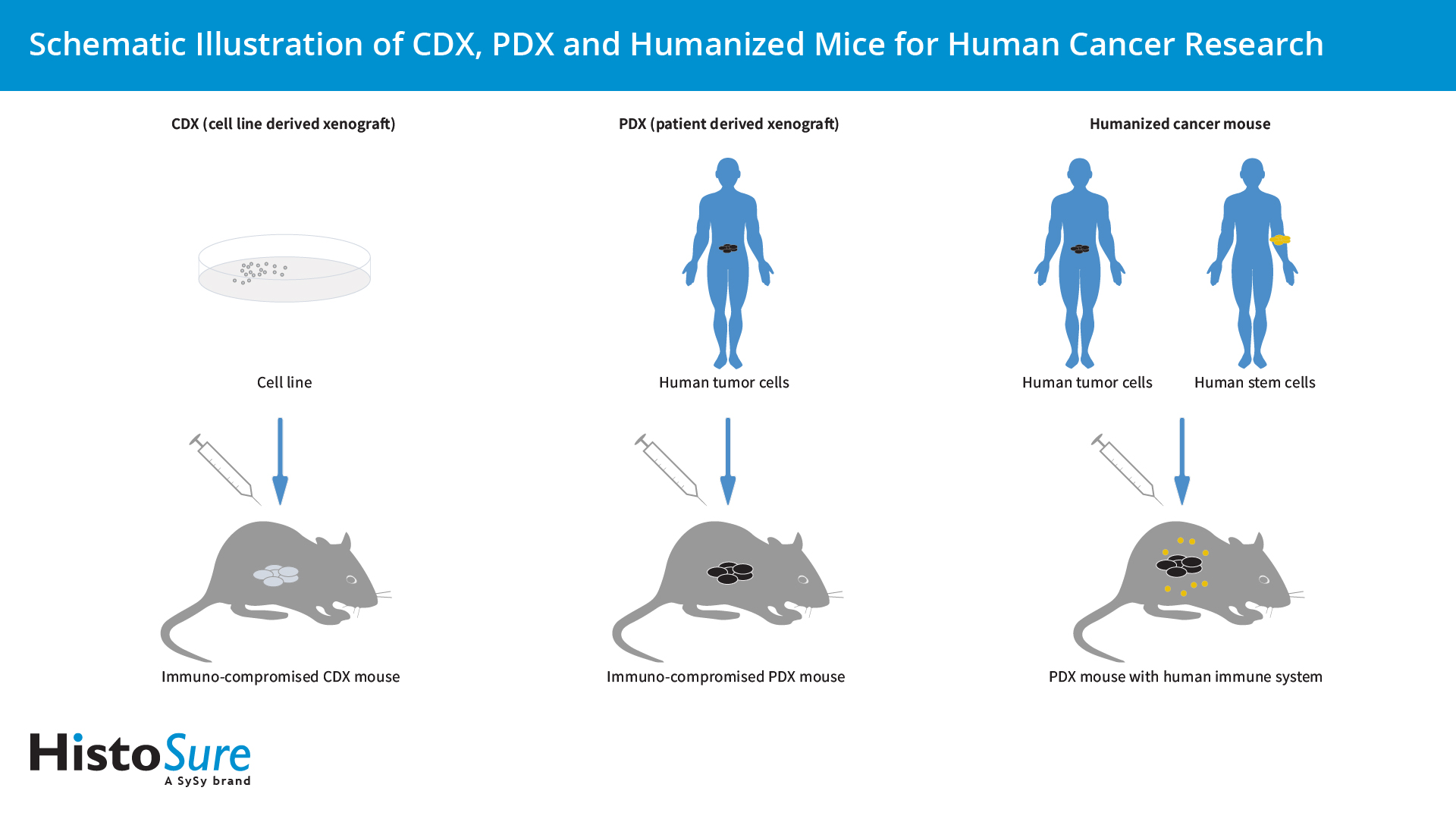
图 2:用于人类癌症研究的CDX、PDX 和人源化小鼠的说明示意图。
由于广泛应用的抗体通常被开发以在多物种中发挥作用,从而使得人源化小鼠模型的组织学分析变得更为复杂,导致在人源化小鼠模型不能区分人类和小鼠组分。物种特异性HistoSure异种移植病理学抗体正是因此而特殊设计和开发的,可填补此抗体缺口。
在人源化小鼠嵌合体背景下区分人类和鼠类细胞
当异种移植人类来源细胞到免疫缺陷小鼠中时,它们会成熟自然地跟随植入的细胞。肿瘤发育且用假定的抗癌物质来治疗是临床前肿瘤学研究的一个中心问题。
HistoSure提供多种针对标记蛋白的人类和小鼠特异性抗体,可用来安全追踪此系统中人类细胞的发育。
Lamin B1是核纤层的基本组分,可在大多数细胞类型中表达。虽然肿瘤攻击性和侵略性可引起Lamin B1表达异常 (reviewed in Evangelisti et al., 2021),但同时检测小鼠和人类Lamin B1可用来在混合背景下可视化人类和鼠类细胞起源(图3A)。
Ki67是细胞增殖的标记物,在治疗响应中是一个重要的生物标记物。人类和小鼠Ki67的免疫组化双重染色可用来同时量化人类和鼠类细胞区室中的增殖 (图3B)。
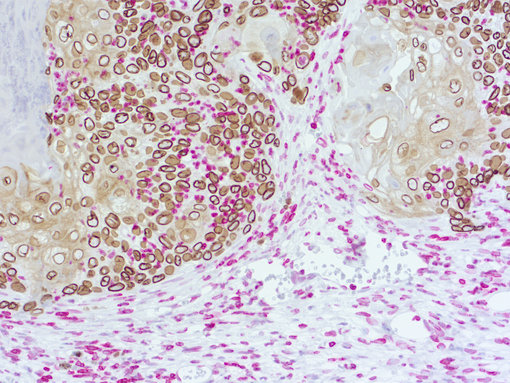
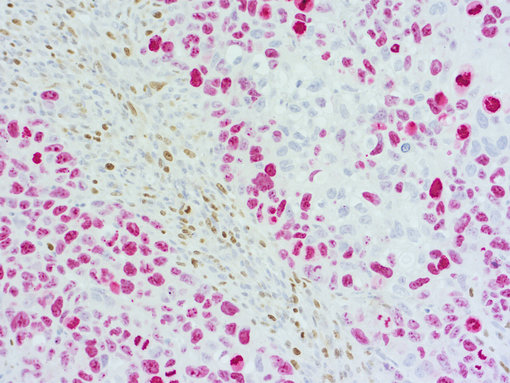
图3a:使用大鼠抗-人类 Lamin B1 (cat.no. HS-404 017; DAB, 棕色) 和兔抗-小鼠 Lamin B1 (cat.no. HS-404 003; AP-RED, 红色)抗体,对患者来源的肺癌模型进行免疫组化双层染色。细胞核由苏木精复染。
图 3b:使用兔抗-人类 Ki67 (cat.no. HS-398 003; AP-RED, 红色) 和大鼠抗小鼠Ki67 (cat.no. HS-398 117; DAB, 棕色)抗体,对患者来源的胰腺癌模型进行免疫组化双重染色。细胞核由苏木精复染。
细胞角蛋白 7 (CK7)是一种类型II角蛋白,可在内脏器官腔内的单层上皮、腺管及血管中特殊表达。HistoSure人类特异性抗-CK7大鼠单克隆抗体可特别检测CK7在人类肿瘤细胞中的表达,而不是鼠类肿瘤环境中。
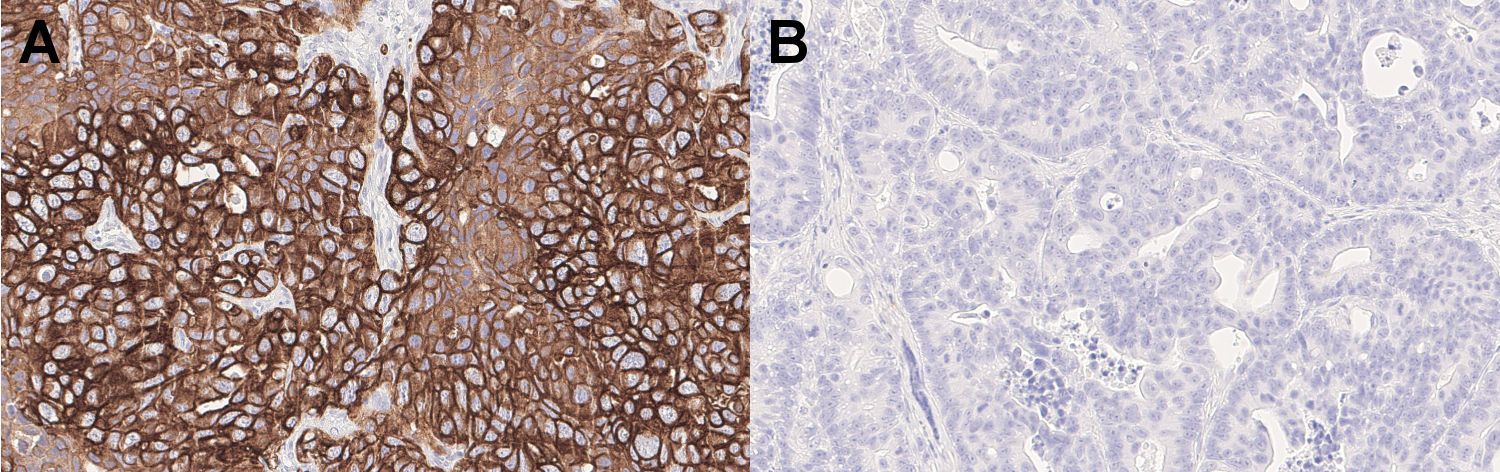
图4:使用大鼠抗-细胞角蛋白 7 (cat. no. HS-454 017, 稀释比例 1:100, DAB)抗体,对经福尔马林林固定、石蜡包埋的切片:(A) 一个 CK7-阳性人类胰腺恶性肿瘤;(B) )一个CK7-阴性人类结肠癌移入免疫功能不全的小鼠(异种移植)进行免疫组化染色。这种抗体是完全人类特异性抗体,不对鼠类CK7阳性细胞染色。细胞核被苏木精复染为蓝色。
在人源化小鼠中检测人类免疫细
人类免疫系统移入免疫缺陷小鼠的成分和持续时长取决于来源和人类造血干细胞(HSCs)的移植途径 (Hess et al., 2020; Curran et al., 2019),还有移植所用的小鼠品系 (Mian et al., 2021)。人类PBMCs的注入允许成熟T细胞快速移植,然而,人类B细胞仅在低水平存在,并且小鼠快速地患有移植物抗宿主病。而注射人类造血干细胞到NSG品系中,会导致更多样化的人类细胞群。这个模型最主要的缺点是需要时间来创建,并且,由于人类初级淋巴器官的缺失,此模型也缺乏功能性的B细胞和T细胞区室。但在HSC注射前,手术移入人类胎肝和胸腺片段可克服此缺陷,并可使多种人类免疫细胞系进行系统性的种群恢复 (reviewed in Curran et al., 2019)。
物种特异性HistoSure异种移植病理学抗体能够区分新生人类免疫细胞区室和鼠类驻留免疫细胞。
使用抗体对准人类和小鼠CD45的C端,可观察到人类和鼠类白血球 (图5)。
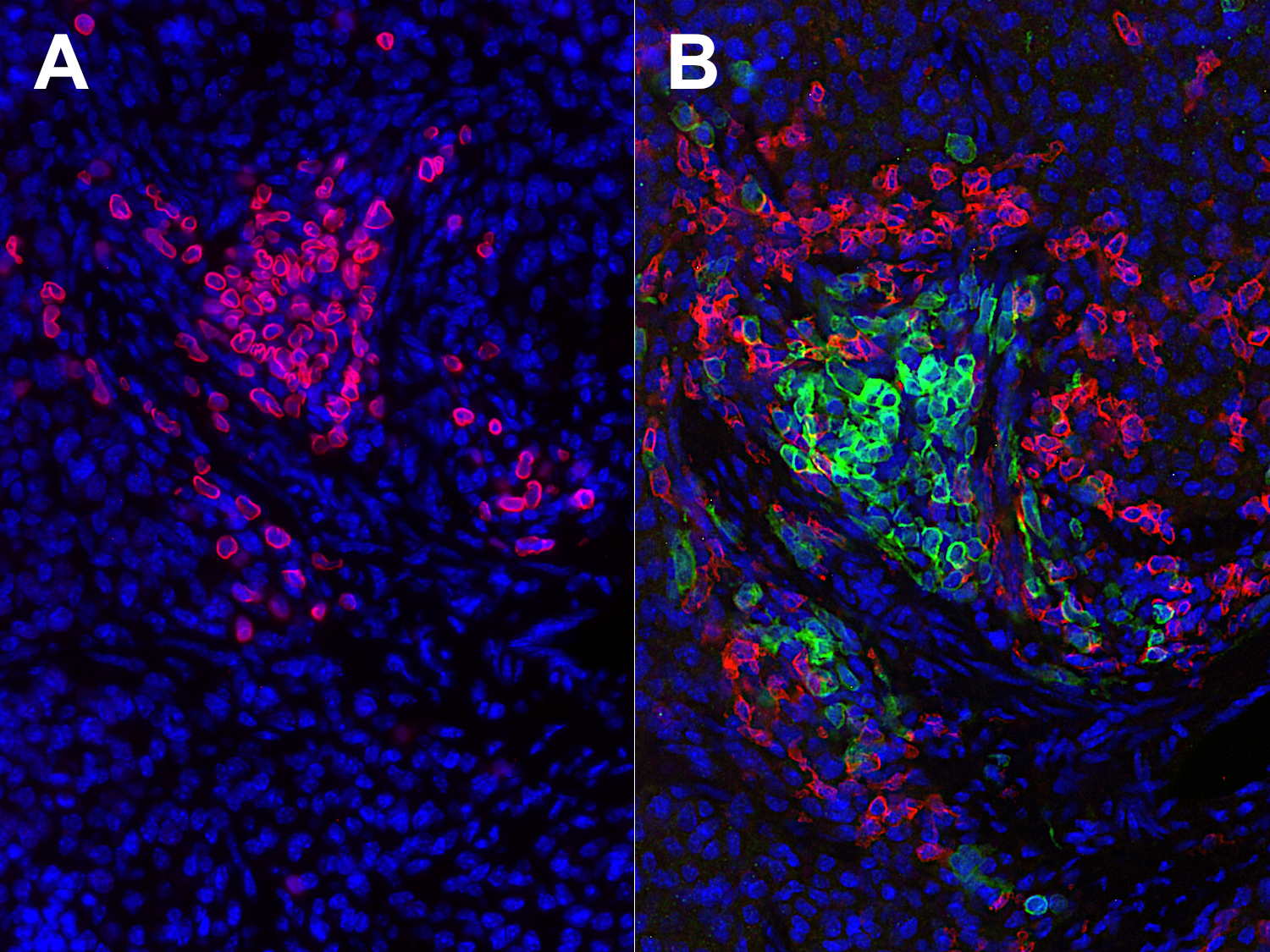
图 5:使用 (A)抗-人类Lamin B1 (HS-404 017, 1:100, 红色) 抗体和(B)抗 -人类 CD45 (HS-427 003, 1:500, 绿色) 和抗-小鼠CD45 (HS-427 017, 1:100, 红色)抗体,对经福尔马林固定、石蜡包埋的人源化小鼠组织切片进行间接免疫染色。细胞核可被DAPI复染为蓝色。
针对免疫细胞系的物种特异性抗体可区分人类和鼠类免疫细胞亚群(图6)。在人源化肺模型中可检测到人类CD11b+ 单核细胞、人类CD68+巨噬细胞和人类CD3e+ T细胞。
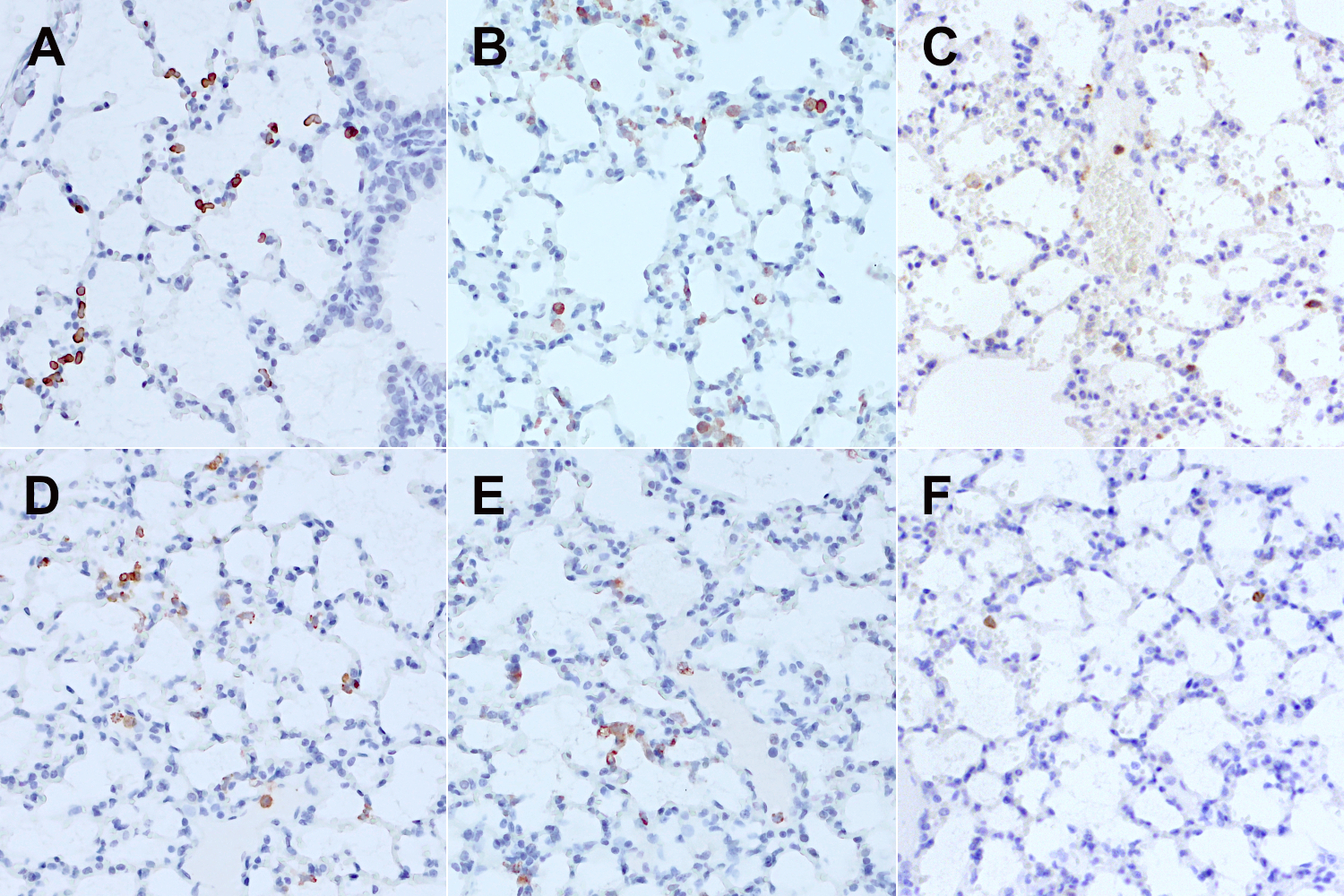
图6:使用(A)抗-人类 Lamin B1 (HS-404 017, 1:100)抗体、(B)抗-人类 CD45 (HS-427 003, 1:1000)抗体、 (C) 抗-小鼠 CD45 (HS-427 017, 1:100)抗体、 (D) 抗-人类CD11b (HS-384 017, 1:100)抗体、(E)抗-人类CD68 (HS-460 017, 1:100)抗体和(F)抗-人类CD3e (HS-413 017, 1:750)抗体,对经福尔马林固定、石蜡包埋的人源化小鼠肺切片进行免疫组化染色。细胞核被苏木精复染为蓝色。
在人源化小鼠肝脏中,小鼠特异性和人类特异性CD11b抗体可用来从驻留鼠类CD11b+细胞中区分浸润的CD11b+细胞(图7)。库普弗细胞,在正常的小鼠肝脏中分布在肝血窦中,被称为CD11blow F4/80high,而单核细胞来源的巨噬细胞是CD11b+ F4/80+(Shan et al., 2020)。在人源化小鼠肝脏中抗-小鼠CD11b的染色发现,与正常小鼠肝脏相比,更多数目的小鼠CD11b+细胞显示出明显不同的细胞形态(图7,第二列)。小鼠CD11b+细胞具有类似于巨噬细胞的形态。这可能是炎症过程的标志(图7)。
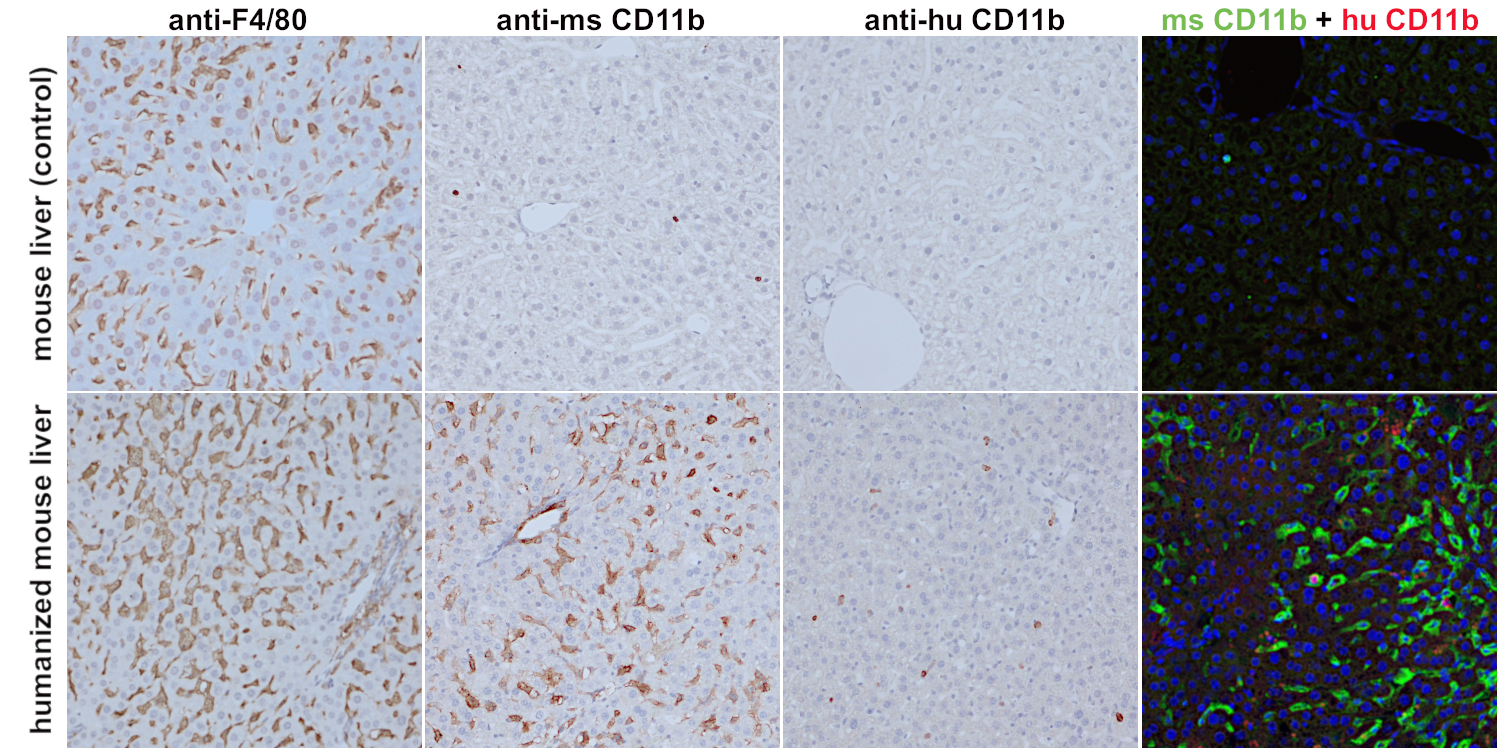
图7:使用第一列:抗-F4/80 (HS-397 008, 1:100)抗体,第二列:抗-小鼠CD11b (HS-384 117, 1:100)抗体和第三列:抗-人类CD11b (HS-384 017, 1:100)抗体,对经福尔马林固定、石蜡包埋的野生型小鼠肝脏(上行)和人源化小鼠肝脏(下行)进行免疫组化染色。细胞核被苏木精复染为蓝色。最后一列:使用抗-小鼠CD11b (HS-384 117, 1:100; 绿色)抗体和抗-人类CD11b (HS-384 017, 1:100; 红色)抗体进行间接免疫染色。细胞核被DAPI复染为蓝色。
| Cat. No. | Product Description | Application | Quantity | Price | Cart |
|---|
HS-384 017 | CD11b, rat, monoclonal, purified IgG IgG human specific | WB IHC-P | 200 µl | US$420.00 | |
HS-384 117 | CD11b, rat, monoclonal, purified IgG IgG mouse specific | WB IHC IHC-P IHC-Fr | 200 µl | US$420.00 | |
HS-439 003 | CD19, rabbit, polyclonal, affinity purifiedaffinity mouse specific | WB ICC IHC IHC-P | 200 µl | US$375.00 | |
HS-413 017 | CD3e, rat, monoclonal, purified IgG IgG human specific | WB IHC-P | 200 µl | US$420.00 | |
HS-413 108 | CD3e, rabbit, monoclonal, recombinant IgGrecombinant IgG mouse specific | IHC IHC-P | 100 µl | US$420.00 | |
HS-427 003 | CD45, rabbit, polyclonal, affinity purifiedaffinity human specific | WB ICC IHC-P | 50 µg | US$375.00 | |
HS-427 017 | CD45, rat, monoclonal, purified IgG IgG mouse specific | IHC IHC-P IHC-Fr | 200 µl | US$420.00 | |
HS-460 017 | CD68, rat, monoclonal, purified IgG IgG human specific | WB ICC IHC-P | 200 µl | US$420.00 | |
HS-454 017 | Cytokeratin7, rat, monoclonal, purified IgG IgG human specific | WB ICC IHC-P | 200 µl | US$420.00 | |
HS-397 008 | F4/80, rabbit, monoclonal, recombinant IgGrecombinant IgG | WB IHC IHC-P | 100 µl | US$420.00 | |
HS-398 003 | Ki67, rabbit, polyclonal, affinity purifiedaffinity human specific | IHC-P | 200 µl | US$455.00 | |
HS-398 117 | Ki67, rat, monoclonal, purified IgG IgG mouse specific | ICC IHC IHC-P | 200 µl | US$420.00 | |
HS-404 003 | Lamin B1, rabbit, polyclonal, affinity purifiedaffinity mouse specific | WB ICC IHC IHC-P | 200 µl | US$375.00 | |
HS-404 017 | Lamin B1, rat, monoclonal, purified IgG IgG human specific | WB ICC IHC-P | 200 µl | US$420.00 |
Yue et al., 2014: A comparative encyclopedia of DNA elements in the mouse genome. PMID: 25409824
Mestas et al., 2004. Of mice and not men: differences between mouse and human immunology. PMID: 14978070
Walsh et al., 2017: Humanized mouse models of clinical disease. PMID: 27959627
Panaampon et al., 2021. Establishment of Nude Mice Lacking NK Cells and Their Application for Human Tumor Xenografts. PMID: 33906298
Vladutiu 1993. The severe combined immunodeficient (SCID) mouse as a model for the study of autoimmune diseases. PMID: 8324894
Belizário 2009. Immunodeficient mouse models: An Overview. DOI: 10.2174/1874226200902010079
Mombaerts et al., 1992. RAG-1-deficient mice have no mature B and T lymphocytes. PMID: 1547488
Shinkai et al., 1992. RAG-2-deficient mice lack mature lymphocytes owing to inability to initiate V(D)J rearrangement. PMID: 1547487
Pan et al., 2022. Patient-derived xenograft models in hepatopancreatobiliary cancer. PMID: 35090441
Choi et al., 2018. Studying cancer immunotherapy using patient-derived xenografts (PDXs) in humanized mice.
Olson et al., 2018. Mouse Models for Cancer Immunotherapy Research. PMID: 30309862
Koga et al., 2019. Systematic Review of Patient-Derived Xenograft Models for Preclinical Studies of Anti-Cancer Drugs in Solid Tumors. PMID: 31064068
Tian et al., 2020. Humanized Rodent Models for Cancer Research. PMID: 33042811
Evangelisti et al., 2021. The wide and growing range of lamin B related diseases: from laminopathies to cancer. PMID: 35132494
Hess et al., 2020. Different Human Immune Lineage Compositions Are Generated in Non-Conditioned NBSGW Mice Depending on HSPC Source. PMID: 33193358
Mian et al., 2021. Advances in Human Immune System Mouse Models for Studying Human Hematopoiesis and Cancer Immunotherapy. PMID: 33603749
Shan et al., 2020. Hepatic Macrophages in Liver Injury. PMID: 32362892